
【题目】用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定的终点时不慎少加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
A.4B.7.2C.10D.11.3
科目:高中化学 来源: 题型:
【题目】PX是纺织工业的基础原料,其结构简式如下,下列说法正确的是( )
![]()
A. PX的一氯代物有3种 B. PX的分子式为C8H10
C. PX与乙苯互为同系物 D. PX分子中所有原子都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素的原子序数依次增大。X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。下列说法不正确的是( )
A. 离子半径:W>Z>Y
B. 简单气态氢化物的热稳定性:Y>W
C. Y分别与X、Z、W能形成两种或两种以上的化合物
D. Z与Y、W分别形成的化合物溶于水,溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
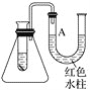
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A. 原子半径由小到大的顺序:X< Y < Z< W
B. Z的最高价氧化物能与水反应生成相应的酸
C. Y单质在一定条件下可以与氧化铁发生置换反应
D. X、Z的氧化物形成的晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kg-1。一种制备黄血盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为_____________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为_______________________。(填化学式)
(3)步骤Ⅴ所用的试剂X是_________________。
(4)工艺中用到剧毒的HCN 溶液,含CN-的废水必须处理后才能排放。己知氢氰酸是一种具有苦杏仁特殊气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①NaCN 的电子式为_________________,反应CNˉ +H2O![]() HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
②处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-“不完全氧化”为OCN-;第二步控制 pH为7.5~8.5,用NaClO“不完全氧化”OCNˉ生生成N2和两种盐。
第一步控制强碱性的主要目的是__________________________________。
第二步反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料,某同学在实验室里用如图所示装置制取硝基苯,主要步骤如下:

①在大试管里将2 mL浓硫酸和1.5 mL浓硝酸混合,摇匀,冷却到50~60 ℃以下;然后逐滴加入1 mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60 ℃的水浴中加热10分钟。
完成下列填空:
(1)指出上图中的错误:__________、____________。
(2)向混合酸中加入苯时,“逐滴加入”“边滴边振荡试管”的目的是__________________________。
(3)反应一段时间后,混合液明显分为两层,上层主要物质是________(填物质名称)。把反应后的混合液倒入盛有冷水的烧杯里,搅拌,可以看到________(填字母)。
a.水面上是含有杂质的硝基苯
b.水底有苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤:①水洗、分液;②将粗硝基苯转移到盛有__________的烧杯中洗涤、用__________(填仪器名称)进行分离;③__________;④干燥;⑤__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com