
(12��)��ѧƽ��ԭ���ڹ�ũҵ�����з�������Ҫ��ָ�����á�
(1)��ӦC(s)+CO2(g)
 2CO(g)ƽ�ⳣ��K�ı���ʽΪ
��
2CO(g)ƽ�ⳣ��K�ı���ʽΪ
��
��֪C(s) +
H2O(g) CO(g)+H2(g)��ƽ�ⳣ��ΪK1��H2(g)��CO2(g)
CO(g)+H2(g)��ƽ�ⳣ��ΪK1��H2(g)��CO2(g)  CO(g)��H2O(g)��ƽ�ⳣ��ΪK2 ����K��K1��K2���ߵĹ�ϵΪ
��
CO(g)��H2O(g)��ƽ�ⳣ��ΪK2 ����K��K1��K2���ߵĹ�ϵΪ
��
(2) ��֪ij�¶��£���Ӧ2SO2+O2 2SO3����ƽ�ⳣ��K=19
2SO3����ƽ�ⳣ��K=19
�ڸ��¶��µ�����̶����ܱ������г���C(SO2)=1mol��L��1��C(O2)=1 mol��L��1������Ӧ�ڸ��¶���SO2ת����Ϊ80��ʱ���÷�Ӧ (��ǡ���)�ﵽ��ѧƽ��״̬����δ�ﵽ���� (�����Ӧ�����淴Ӧ��) ������С�
(3)���ڿ��淴Ӧ��aA(g) +bB(g) cC(g)+dD(g)
��H = a kJ��mol-1��
cC(g)+dD(g)
��H = a kJ��mol-1��
��a+b��c+d������ѹǿƽ����_______(�����Ӧ�����淴Ӧ��)�����ƶ����������¶ȣ�ƽ�����淴Ӧ�����ƶ�����a_______0(���������)
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����12�֣����ݻ��̶�Ϊ2L���ܱ������У�����0.180 molHI��480��ʱ��Ӧ��
2HI��g��H2��g��+I2��g������ϵ��n��HI����ʱ��仯������±���
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n��HI��/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
��Ӧ������10min��Ӧ�������¶Ƚ��ͣ������������ɫ��dz��
��1��0~2min��H2��ƽ����Ӧ�ٶ�Ϊ ����ƽ��ʱ��HI��ת������_________����2����������Ӧ�ǣ� ��Ӧ��ѡ����ȡ����ȣ���
��3��ij�¶���������Ӧƽ��ʱ�����ݡ������¶ȣ�ԭ��ѧƽ���� ��Ӧ�����ƶ�����������桱��������Ӧ���� �����������С�����䡱���������ڻ�������ѹǿ �����������С�����䡱����
��4��480��ʱ����ӦH2��g��+I2��g��2HI��g����ƽ�ⳣ��K��ֵΪ ��
��5��Ҫ����Ӧ2HI��g��H2��g��+I2��g����ƽ�ⳣ�����ɲ�ȡ�Ĵ�ʩ�� ��ѡ����ĸ����
A������HI��ʼŨ��
B������������ͨ��I2
C��ʹ�ø�Ч����
D�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ӱ�ʡʯ��ׯ�и�����ѧ�ڽ�ѧ������⻯ѧ�Ծ� ���ͣ������
(12��)��ѧ��һֱ�����ڡ��˹��̵����ķ����о���
(1)�ϳɰ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92��4 kJ��mol���÷�Ӧ�������仯��ͼ��ʾ��
H=-92��4 kJ��mol���÷�Ӧ�������仯��ͼ��ʾ��
���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�� (���������С�����䡱)��
�ڽ�0��3 mol N2��0��5 mol H2�������������ܱ������У���һ�������´ﵽƽ�⣬�������������ѹǿ��Ϊԭ���� ����ʱH2��ת����Ϊ ������߸�������H2��ת���ʣ����д�ʩ���е��� (��ѡ����ĸ)��
����ʱH2��ת����Ϊ ������߸�������H2��ת���ʣ����д�ʩ���е��� (��ѡ����ĸ)��
| A���������а�ԭ�����ٳ���ԭ���� | B�����������ٳ���һ����H2 |
| C���ı䷴Ӧ�Ĵ��� | D��Һ�������������� |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ��mol
H="+1530" kJ��mol H=+44��0 kJ��mol
H=+44��0 kJ��mol 4NH3(g)+302(g)
4NH3(g)+302(g)  H = kJ��mol���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= �����������������䣬����ѹǿ��Kֵ (���������С�����䡱)��
H = kJ��mol���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= �����������������䣬����ѹǿ��Kֵ (���������С�����䡱)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���Ĵ�ʡ������ѧ�߶���ѧ�����п��Ի�ѧ�Ծ� ���������� ���ͣ������
(10��)��һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ��N2(g)��3H2(g)  2NH3(g)����H��0
2NH3(g)����H��0
��Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺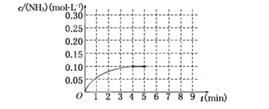
(1)������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)Ϊ______________��
(2)�÷�Ӧ�ﵽƽ��ʱH2��ת����________��
(3)��Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ��ﵽ��ƽ��ʱNH3�����ʵ���Ũ�Ȳ�����Ϊ____________��(�����)
A��0.20 mol��L��1 b��0.12 mol��L��1 c��0.10 mol��L��1 d��0.08 mol��L��1
(4)�ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol��L��1)��������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߣ�
��5�����������Ӧ����ͬ�¶Ⱥ������н��У���ʹ��Ӧ�ﵽƽ��ʱNH3�����ʵ���������ԭƽ����ȣ���ʼ������������ʵ����ʵ���n��N2����n��H2����n��NH3���ֱ�Ϊa��b��c����a��b��c֮��Ӧ������Ĺ�ϵʽΪ��
(6)���÷�Ӧ��298K��398Kʱ�Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2����K1 K2������� ��="��" �� ������ ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�����ѧ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ����������� ���ͣ������
(12��)150 ��ʱ������ͼ��ʾ������(�ܷ�ĸ�������ɻ��������������б��ָ����ϲ�ѹǿ����)�м���4 L N2��H2�Ļ�����壬�ڴ��������³�ַ�Ӧ(����������Բ���)����Ӧ��ָ���ԭ�¶ȡ�ƽ������������Ϊ3.4 L���������������ͬ����������������ܶ�Ϊ5��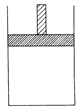
(1)��Ӧǰ���������V(N2)?��V(H2)��____________����Ӧ��ƽ���V(NH3)��____________L���÷�Ӧ��N2ת����Ϊ____________��
(2)��ƽ���������г���0��2 mol��NH3��һ��ʱ���Ӧ�ٴδﵽƽ�⣬�ָ���150 ��ʱ��ô˹����д����������6��44 kJ��������
�ٳ���NH3ʱ�����������ܶȽ�____________���ڴﵽƽ��Ĺ����У����������ܶȽ�____________(���������С�����䡱)����Ӧ���´�ƽ��Ļ�����������������ܶȽ�____________5(�����������������)��
��������Щʵ�������������˵����Ӧ���µ�����ƽ��____________��
| A��������������緢���Ƚ��� |
| B����������ƽ����Է����������ֲ��� |
| C����V(N2)?��V(H2)��?V(NH3)��1��?3?��2ʱ |
| D����������������ٷ����仯ʱ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������ʡ��Ϫһ�и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ�ʵ����
����12�֣����ݻ��̶�Ϊ2L���ܱ������У�����0.180 molHI��480��ʱ��Ӧ��
2HI��g�� H2��g��+I2��g������ϵ��n��HI����ʱ��仯������±���
H2��g��+I2��g������ϵ��n��HI����ʱ��仯������±���
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n��HI��/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
 2HI��g����ƽ�ⳣ��K��ֵΪ ��
2HI��g����ƽ�ⳣ��K��ֵΪ �� H2��g��+I2��g����ƽ�ⳣ�����ɲ�ȡ�Ĵ�ʩ�� ��ѡ����ĸ����
H2��g��+I2��g����ƽ�ⳣ�����ɲ�ȡ�Ĵ�ʩ�� ��ѡ����ĸ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com