
| 0.03mol-0.01mol |
| 0.2L |
| 1×10-14 |
| 0.1 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )| A、12,大立方体的12条棱的中点 |
| B、8,大立方体的8个顶角 |
| C、6,大立方体的6个面的中心 |
| D、14,大立方体的8个顶角和6个面的中心 |
查看答案和解析>>
科目:高中化学 来源: 题型:
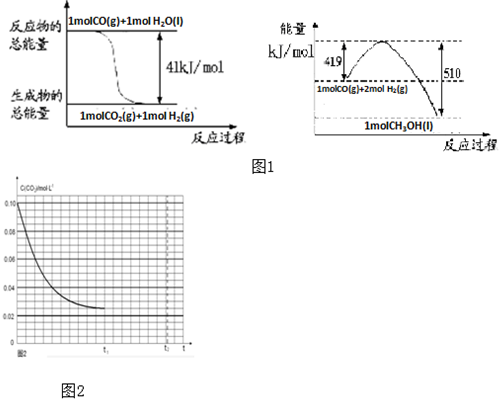
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.
往NaOH溶液中通入CO2气体充分反应后,在低压和低温下,小心地将溶液蒸干,得到白色的固体M,通入CO2的体积V(CO2)(标准状况)与M的质量W的关系如下图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
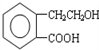 ,可通过它用不同化学反应分别制得B、C和D 三种物质.
,可通过它用不同化学反应分别制得B、C和D 三种物质.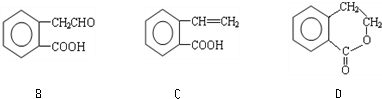
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com