
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L﹣1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为: .
(2)硫酸的物质的量浓度:c(H2SO4)= .
(3)该HCl气体在标准状况下的体积为 mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为 g.
考点: 化学方程式的有关计算.
分析: 一定体积的HCl气体,将其溶于100mL稀硫酸中,向混合溶液中加入氢氧化钠溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,恰好呈中性,溶液中溶质为Na2SO4 、NaCl,再向中和后的溶液中加过量的Ba(OH)2溶液,发生反应SO42﹣+Ba2+=BaSO4 ↓,所得沉淀质量为2.33g为BaSO4的质量,根据硫酸钡的质量,利用硫酸根守恒计算计算硫酸的物质的量,根据c=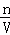 计算硫酸的物质的量浓度,进而计算硫酸反应的氢氧化钠的物质的量,计算与盐酸反应的氢氧化钠的物质的量,再根据方程式计算HCl的物质的量;
计算硫酸的物质的量浓度,进而计算硫酸反应的氢氧化钠的物质的量,计算与盐酸反应的氢氧化钠的物质的量,再根据方程式计算HCl的物质的量;
(1)中和后的溶液中加入过量的Ba(OH)2溶液,发生硫酸钠和氢氧化钡的反应;
(2)沉淀质量为2.33g为BaSO4的质量,根据硫酸钡的质量,利用硫酸根守恒计算计算硫酸的物质的量,根据c=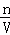 计算硫酸的物质的量浓度;
计算硫酸的物质的量浓度;
(3)根据硫酸钡的量计算硫酸反应的氢氧化钠的物质的量,计算与盐酸反应的氢氧化钠的物质的量,再根据方程式计算HCl的物质的量,从而求出HCl气体在标准状况下的体积;
(4)根据发生反应CO32﹣+2H+═CO2↑+H2O,和碳酸根守恒以及m=nM计算.
解答: 解:(1)一定体积的HCl气体,将其溶于100mL稀硫酸中,向混合溶液中加入氢氧化钠溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,恰好呈中性,溶液中溶质为Na2SO4 、NaCl,再向中和后的溶液中加过量的Ba(OH)2溶液,发生反应Na2S04+Ba(OH)2═BaS04↓+2NaOH,
故答案为:Na2S04+Ba(OH)2═BaS04↓+2NaOH;
(2)2.33gBaSO4的物质的量为:n=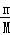 =
=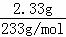 =0.01mol,根据硫酸根守恒n(H2SO4)=n(BaSO4)=0.01mol,所以硫酸的物质的量浓度为
=0.01mol,根据硫酸根守恒n(H2SO4)=n(BaSO4)=0.01mol,所以硫酸的物质的量浓度为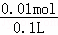 =0.1mol/L;
=0.1mol/L;
故答案为:0.1mol/L;
(3)根据方程式H2SO4+2NaOH=Na2SO4 +2H2O可知,以0.01mol硫酸反应需要氢氧化钠的物质的量为0.01mol×2=0.02mol,故与盐酸反应氢氧化钠的物质的量为:0.01L×4mol/L﹣0.02mol=0.02mol,
由方程式HCl+NaOH=NaCl+H2O可知,n(HCl)=n(NaOH)=0.02mol,V=n×Vm=0.02mol×22.4mol/L=0.448L=448mL,
故答案为:448;
(4)向混合溶液中加入氢氧化钠溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,恰好呈中性,n(H+)=n(OH﹣)=0.04mol,加入Na2CO3•10H2O晶体,发生反应CO32﹣+2H+═CO2↑+H2O,n(Na2CO3•10H2O)=n(CO32﹣)=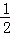 n(H+)=0.02mol,所以m(Na2CO3•10H2O)=nM=0.02mol×286g/mol=5.72g,
n(H+)=0.02mol,所以m(Na2CO3•10H2O)=nM=0.02mol×286g/mol=5.72g,
故答案为:5.72.
点评: 本题考查根据方程式的计算,题目难度中等,清楚反应过程是解题的关键,注意守恒思想的运用.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
称取两份铝粉,第一份加足量的氢氧化钠溶液,第二份加足量盐酸,如要放出等体积的气体(同温、同压下),两份铝粉的质量之比为()
A. 1:2 B. 1:3 C. 3:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6molCO2和0.3mol水;回答下列问题:
(1)A的电子式 ,B的结构简式 或.
(2)A和B中,能使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型:
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,
(4)等质量的A、B完全燃烧时消耗O2的物质的量 (填“A>B”、“A<B”或“A=B”).
(5)B与H2加成反应的产物的二氯代物的结构简式:、、、.
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合,离子方程式正确的是()
A. HCO3﹣+OH﹣→H2O+CO32﹣
B. 2 HCO3﹣+Ba(OH)2→BaCO3↓+2H2O+CO32
C. HCO3﹣+Ba2++OH﹣→BaCO3↓+H2O
D. 2 HCO3﹣+Ba2++2OH﹣→BaCO3↓+2H2O+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知M2O7x﹣+3S2﹣+14H+=2M3++3S↓+7H2O,则M2O7x﹣中的M的化合价为()
A. +2 B. +3 C. +4 D. +6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列原子或离子原子核外电子排布不属于基态排布的是( )
|
| A. | N:1s22s22p3 | B. | S2﹣:1s22s22p63s23p6 |
|
| C. | Na:1s22s22p53s2 | D. | Si:1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒中,都互为等电子体的是( )
|
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3﹣、OCN﹣ |
|
| C. | CO32﹣、NO3﹣、BCl3 | D. | SiF4、SiO44﹣、SO32﹣、PO43﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.下列说法正确的是( )

|
| A. | 钠、氯都属于金属元素 |
|
| B. | 氯化钠是由a、d两种粒子构成的 |
|
| C. | 氯的相对原子质量是35.45g |
|
| D. | a表示的是一种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
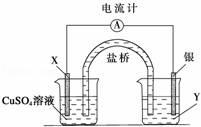
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填具体电极如Ag”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com