
【题目】以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4.2H2O的一种实验流程如图:
![]()
![]()
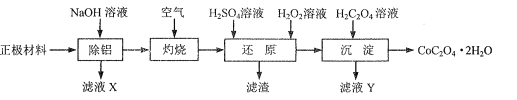
(1)“除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有___。
(2)“灼烧”的主要目的是___。
(3)“还原”步骤温度在70℃左右,LiCoO2发生反应的化学方程式为___。若该步骤用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但其缺点是___。
(4)“沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是___。
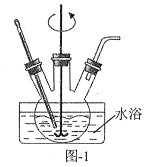
(5)设计由“滤液X”制备纯净的Al2O3的实验方案。(已知含铝物种浓度与pH的关系如图所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)___。
【答案】加快反应速率或延长反应时间 除去C 2LiCoO2+3H2SO4+H2O2![]() 2CoSO4+Li2SO4+O2+4H2O 会产生有毒的Cl2 静置,在上层清液中继续滴加H2C2O4溶液,若不出现浑浊,则Co2+已沉淀完全 向“滤液X”中滴加H2SO4溶液,适时用pH试纸测溶液的pH,当pH介于6~8时,过滤,用蒸馏水洗涤沉淀,直至滤液加BaCl2溶液不再出现白色浑浊为止,将所得沉淀灼烧至沉淀不再减少,冷却,即得Al2O3
2CoSO4+Li2SO4+O2+4H2O 会产生有毒的Cl2 静置,在上层清液中继续滴加H2C2O4溶液,若不出现浑浊,则Co2+已沉淀完全 向“滤液X”中滴加H2SO4溶液,适时用pH试纸测溶液的pH,当pH介于6~8时,过滤,用蒸馏水洗涤沉淀,直至滤液加BaCl2溶液不再出现白色浑浊为止,将所得沉淀灼烧至沉淀不再减少,冷却,即得Al2O3
【解析】
正极材料主要含LiCoO2、Al、C,加入NaOH溶液,Al与NaOH反应生成NaAlO2溶液,剩余固体在空气中灼烧,C变成CO2,剩余的LiCoO2与H2SO4溶液和H2O2溶液发生氧化还原反应:2LiCoO2+3H2SO4+H2O2![]() 2CoSO4+Li2SO4+O2+4H2O,沉淀时发生反应Co2++C2O42-+2H2O===CoC2O4·2H2O,得到滤液Y为LiSO4等,根据分析可以解答问题。
2CoSO4+Li2SO4+O2+4H2O,沉淀时发生反应Co2++C2O42-+2H2O===CoC2O4·2H2O,得到滤液Y为LiSO4等,根据分析可以解答问题。
根据上述分析可得:
(1) 提高铝的去除率的措施有加快反应速率或延长反应时间,故答案为:加快反应速率或延长反应时间;
(2) 剩余固体在空气中灼烧,C变成CO2,因此灼烧的目的是除去C,故答案为除去C;
(3) LiCoO2与H2SO4溶液和H2O2溶液发生氧化还原反应,反应方程式为:2LiCoO2+3H2SO4+H2O2![]() 2CoSO4+Li2SO4+O2+4H2O,故答案为:2LiCoO2+3H2SO4+H2O2
2CoSO4+Li2SO4+O2+4H2O,故答案为:2LiCoO2+3H2SO4+H2O2![]() 2CoSO4+Li2SO4+O2+4H2O;
2CoSO4+Li2SO4+O2+4H2O;
(4) 用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但会产生有毒的Cl2,故答案为:会产生有毒的Cl2;
(5)证明Co2+已沉淀完全的实验操作及现象:静置,在上层清液中继续滴加H2C2O4溶液,若不出现浑浊,则Co2+已沉淀完全;
(6) “滤液X”为NaAlO2溶液,由“滤液X”制备纯净的Al2O3的实验方案为:向“滤液X”中滴加H2SO4溶液,适时用pH试纸测溶液的pH,当pH介于6~8时,过滤,用蒸馏水洗涤沉淀,直至滤液加BaCl2溶液不再出现白色浑浊为止,将所得沉淀灼烧至沉淀不再减少,冷却,即得Al2O3。


科目:高中化学 来源: 题型:
【题目】B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____;Ti原子核外共有________种运动状态不同的电子。
(2)BH3分子与NH3分子的空间结构分别为_________;BH3与NH3反应生成的BH3·NH3分子中含有的化学键类型有_______,在BH3·NH3中B原子的杂化方式为________。
(3)N和P同主族。科学家目前合成了N4分子,该分子中N—N—N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途___________。(写出一种即可)
(4)NH3与Cu2+可形成[Cu(NH3)4]2+配离子。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是____。
(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物乙的沸点明显高于化合物甲,主要原因是______。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
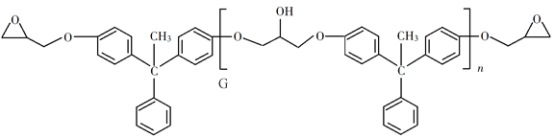
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:

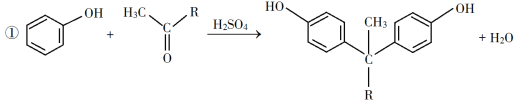
已知以下信息:

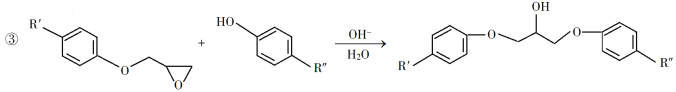 回答下列问题:
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为__________、__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、__________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
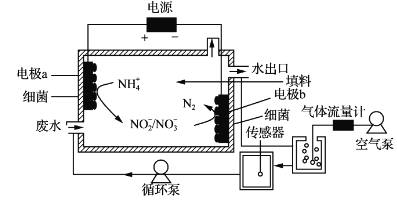
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是
2C(气)+2D(固)达到平衡的标志的是
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④恒容下,混合气体的密度不再变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
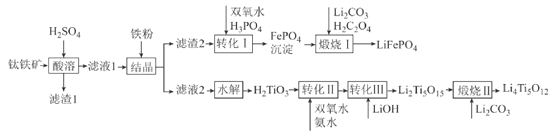
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__。
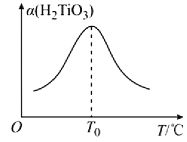
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__。
(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示不正确的是
A.葡萄糖的最简式:CH2O
B.次氯酸的结构式:H-O-Cl
C.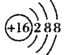 可以表示32S2- ,也可以表示34S2-
可以表示32S2- ,也可以表示34S2-
D.![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是
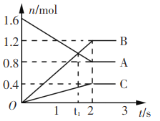
A.该反应的化学方程式为2A![]() B+3C
B+3C
B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s)
C.t1时刻,该反应达到化学平衡状态
D.反应开始至1s时,生成C的物质的量大于0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com