
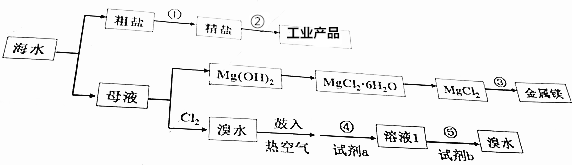
| A. | 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 | |
| B. | 步骤②的工业产品包括:H2、Cl2、NaOH、Na | |
| C. | 步骤③的方法为点解饱和MgCl2溶液 | |
| D. | 步骤④、⑤中,若试剂a为SO2水溶液,则试剂b可以是Cl2 |
分析 海水晒盐后得到粗盐,淡水,粗盐提纯除去所含杂质Ca2+、Mg2+、SO42-及泥沙,得到精盐,电解制备氯气;
母液中主要是溴离子和镁离子,通入氯气氧化溴离子为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁.
解答 解:海水晒盐后得到粗盐,淡水,粗盐提纯除去所含杂质Ca2+、Mg2+、SO42-及泥沙,得到精盐,电解制备氯气;
母液中主要是溴离子和镁离子,通入氯气氧化溴离子为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁,
A、Ca2+用碳酸钠转化为沉淀、Mg2+用NaOH转化为沉淀、SO42-用氯化钡溶液转化为沉淀,先除去Mg2+或SO42-,然后再加入过量的碳酸钠除去Ca2+以及过量的Ba2+杂质,过滤后再加盐酸除去过量的NaOH和碳酸钠,故A正确;
B、步骤②为电解氯化钠制备工业产品,电解熔融状态下的氯化钠制备金属钠和氯气,电解饱和食盐水制备氢氧化钠、氯气和氢气,故B正确;
C、制备镁的方法为电解熔融的氯化镁,故C错误;
D、步骤⑤⑤已经获得Br2浓度较低,应进行富集,与二氧化硫反应后得到浓度角度的溴化氢溶液,然后通入氯气可得到纯溴,故D正确;
故选C.
点评 本题以海水资源及其利用为载体综合考查物质的分离、制备,侧重于学生的分析、实验能力的考查,题目涉及金属的冶炼、物质的分离和提纯、氧化还原反应等知识点,能从总体上分析工艺流程图,知道每一步发生的反应或操作方法,熟悉常见物质的分离方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 ;B和C形成的化合物的电子式为
;B和C形成的化合物的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属被腐蚀的本质是:M+nH2O=M(OH)n+n/2H2↑ | |
| B. | 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 | |
| C. | 马口铁(镀锡)镀层破损后被腐蚀时,首先是镀层被氧化 | |
| D. | 常温下,置于空气中的金属主要发生化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
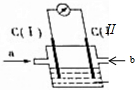 如右图所示的原电池装置中,电解质溶液为氢氧化钠溶液,a、b分别为H2、O2中的一种,C(Ⅰ)、C(Ⅱ)均为多孔石墨电极.通入气体后,发现电流表指针发生如图所示偏转.则:
如右图所示的原电池装置中,电解质溶液为氢氧化钠溶液,a、b分别为H2、O2中的一种,C(Ⅰ)、C(Ⅱ)均为多孔石墨电极.通入气体后,发现电流表指针发生如图所示偏转.则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 空气的只要作用是提供氧气作氧化剂 | |
| B. | 电解法中ClO2在阴极发生的电极反应式为:ClO2+Na++e-=NaClO2 | |
| C. | 吸收法中加入H2O2主要是做还原剂 | |
| D. | 从环保的角度考虑,电解法比吸收法更环保 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )
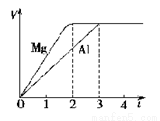
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com