
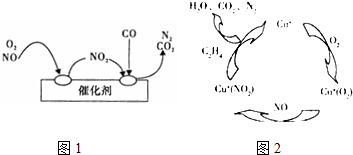
分析 (1)依据图1转化关系可知反应物为一氧化氮、氧气和一氧化碳,生成物为氮气和二氧化碳,结合原子个数守恒、得失电子守恒书写方程式;
(2)①依据反应过程中C2H4→CO2,中元素化合价变化解答;
②依据得失电子守恒计算:一氧化氮转化为氮气得到的电子总数=乙烯失去电子总数;
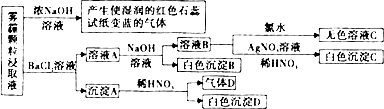
(3)①雾霾浸取液中加入浓NaOH后产生使红色石蕊试纸变蓝的气体,说明原溶液中有NH4+;溶液A中加入NaOH后有白色沉淀,说明原溶液中有HCO3_,HCO3_和OH_反应生成C032-,与Ba2+反应生成BaCO3沉淀.溶液B加入AgNO3生成白色沉淀,说明溶液中一定无Br-,据此解答;
②一氧化氮与氧气反应生成红棕色二氧化氮,据此解答.
解答 解:(1)净化过程中一氧化氮、一氧化碳和氧气反应生成二氧化碳和氮气,化学方程式为2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
故答案为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
(2)①依据图2可知:反应过程中C2H4→CO2,碳元素化合价从-2价升高到+4价,发生氧化反应,所以乙烯做还原剂,故答案为:乙烯;
②根据图示,该过程发生的反应为6NO+3O2+2C2H4$\frac{\underline{\;催化剂\;}}{\;}$3N2+4CO2+4H2O.该反应中还原剂是乙烯.NO排放量为0.09g/km,则该车行驶100km,排放的NO为9g,即0.3mol,消耗的乙烯为0.1mol,质量为2.8g,
故答案为:2.8g;
(3)①雾霾浸取液中加入浓NaOH后产生使红色石蕊试纸变蓝的气体,说明原溶液中有NH4+;溶液A中加入NaOH后有白色沉淀,说明原溶液中有HCO3_,HCO3_和OH_反应生成C032-,与Ba2+反应生成BaCO3沉淀.溶液B加入AgNO3生成白色沉淀,说明溶液中一定无Br-,
故答案为;①HCO3-、NH4+;Br?;
②气体D遇空气会变成红棕色,说明D为NO,沉淀A中一定有BaSO3,能与稀硝酸发生氧化还原反应生成NO,故答案为:BaSO3.
点评 本题考查了环境的污染与防治、常见离子的检验方法,准确把握题干信息、明确常见离子检验方法是解题关键,题目难度较大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题

 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸溶液:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜与硝酸银溶液:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙加入稀盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 氢氧化钠溶液加入稀硫酸:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用容量瓶配制100ml 2.000mol/L的NaCl | |
| B. | 用分液漏斗分离乙醇和水 | |
| C. | 用烧杯溶解FeCl3试样 | |
| D. | 用电子天平称量NaCl固体5.85g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L HF中含有分子的数目为0.5NA | |
| B. | 0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA | |
| C. | 1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
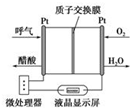 酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
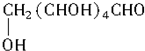 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com