
【题目】下列关于物质分类的叙述中,不正确的是
A.硫酸属于酸B.液氨属于混合物
C.二氧化碳属于氧化物D.氢氧化钙属于碱
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
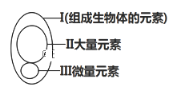
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
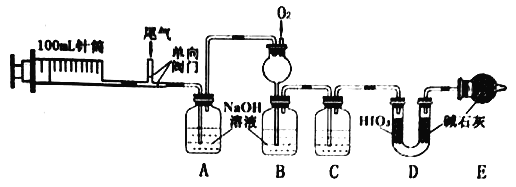
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家韦尔斯泰特,经过10年的艰苦努力,韦尔斯泰特用成吨的绿叶,终于提取到了绿叶中的神秘物质——叶绿素,正是因为叶绿素在植物体内所起到的奇特作用,才使我们人类得以生存。可以说,没有光合作用就没有人类的生存和发展。由于成功地提取了叶绿素,1915年,韦尔斯泰特荣获了诺贝尔化学奖。叶绿素的结构如图
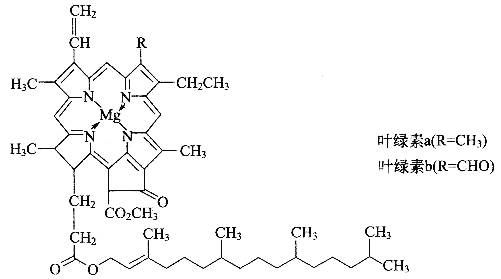
(1)光合作用产生氧气,氧气的一种同素异形体O3,在高空能吸收大量紫外线,保护地球上的人类和动植物免遭短波紫外线的伤害。请写出一种短周期元素形成的O3等电子体分子________,该分子的空间构型为________,中心原子的杂化类型是_________。
(2)镁是叶绿素中的重要组成元素,镁的基态原子价电子排布式为__________,叶绿素中镁形成的化学键类型有___________________。叶绿素不易溶于水,而溶于有机溶剂,如乙醇、丙酮、乙醚、氯仿等,是因为______________________________。
(3)叶绿素构成元素中,又属于二周期元素中,第一电离能由大到小的顺序(请用元素符号表示):_______________,理由是______________________________。
(4)叶绿素的构成元素中,H和Mg属于第一、三周期的元素,能形成一种离子型储氢材料,晶体结构如图所示:
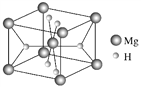
则 该晶体的化学式为__________________,已知该晶体的密度为ρ g·cm-3,晶胞的体积为________ cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 在1 L0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
B. 常温常压下,Na2O2与足量H2O反应,生成4.48LO2,转移电子的数目为0.2NA
C. 在密闭容器中充入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA
D. 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
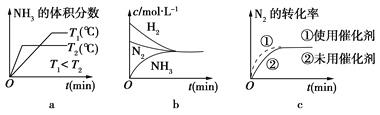
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
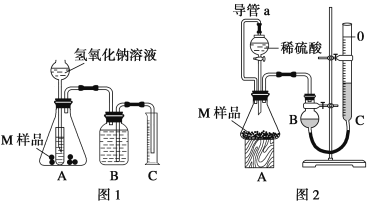
(1)写出实验1中可能发生反应的离子方程式:______________________________。
(2)实验1装置中小试管的作用是__________________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:
①___________________②___________________。
(4)M样品中铜的质量的数学表达式为(用V1和V2 表示):__________________________。
(5)实验1进行实验前,B瓶中水没有装满,使测得气体体积____________ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________。
(6)该实验需要0.50 mol·L-1的NaOH溶液470 mL,请回答下列问题:
①配制时应称量______g NaOH,称量时需要托盘天平、______、______ (填仪器名称)。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(7)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com