
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
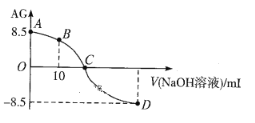
A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
【答案】D
【解析】
A项,D点lg c(H+)/c(OH-)=-8.5,则c(H+)/c(OH-)=10-8.5,KW= c(H+)×c(OH-)=10-14,所以c(H+)=1.0×10-11.25,pH=11.25,故A项正确;
B项,B点溶液为等浓度的HNO2和NaNO2溶液,溶液中存在①电荷守恒:c(H+)+c(Na+)=c(OH-)+c(NO2-),②物料守恒:2c(Na+)=c(HNO2)+ c(NO2-),将①×2-②得:2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故B项正确;
C项,C点lg c(H+)/c(OH-)=0,则c(H+)/c(OH-)=1,HNO2的电离程度与NaNO2的水解程度相同,加入NaOH溶液的体积小于20.00 mL ,故C项正确;
D.A点lg c(H+)/c(OH-)=8.5,则c(H+)/c(OH-)=108.5,KW= c(H+)×c(OH-)=10-14,所以c2(H+)=1.0×10-6.5,由于c(H+)与c(NO2-)近似相等,所以HNO2的电离常数Ka= c(H+)×c(NO2-)/ c(HNO2)= 1.0×10-6.5/(0.1-1.0×10-6.5)= 1.0×10-6.5,故D项错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
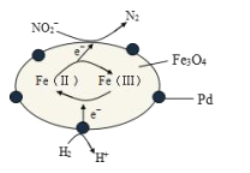
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力
(4)SF6被广泛用作高压电气设备绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系的键能。则S—F的键能为_______kJ·mol-1。

(5)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是_____________;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=__________nm (列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。在850℃时,K=1。
CO2(g)+H2(g) △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__________1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向_____________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_______________。
Ⅱ.在一固定容积的密闭容器中,保持一定温度,在一定条件下发生以下反应:2A(g)+B(g)![]() 3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
3C(g),已知加入1 mol A和2 mol B且达到平衡后,生成了a mol C。
(3)达到平衡时,C在反应混合气体中的体积分数是___(用含a的代数式表示)。
(4)在相同的实验条件下,若在同一容器中改为加入2 mol A和4 mol B,达到平衡后,C的物质的量为___mol(用含a的代数式表示)。此时C在反应混合气体中的体积分数与原平衡相比___(填“增大”“减小”或“不变”)。
(5)在相同实验条件下,若在同一容器中改为加入2 mol A和5 mol B,若要求平衡后C在反应混合气体中的体积分数仍与原平衡相同,则还应加入___mol C。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L1二元弱酸H2A溶液中加入氢氧化钾固体改变溶液的pH,溶液中的H2A、HA、A2的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =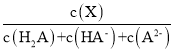 ]。下列叙述错误的是
]。下列叙述错误的是
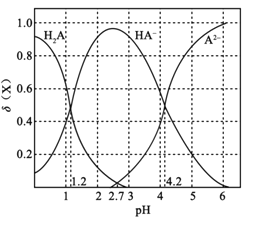
A.pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH)
B.常温下,H2A的电离平衡常数Ka2=1042
C.pH=2.7时,c(HA)>c(H2A)=c(A2)
D.KHA溶液中离子浓度为c(K+)>c(HA)>c(OH)>c(H2A)>c(H+)>c(A2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
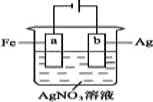

①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A. ①③B. ③④C. ①②④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.最外层都只有2个电子的元素原子性质一定相似
B.同一周期元素中,第一电离能随原子序数增加而增大
C.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
D.H2O2是一种含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:①称取ng草酸晶体配成100.00mL水溶液;②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。反应生成MnSO4在水溶液中基本无色,试回答下列问题:
(1)实验台上有以下仪器,实验中不需要的是___(填序号)。
a.托盘天平(带砝码、镊子) b.滴定管 c.100 mL容量瓶 d.烧杯 e.漏斗 f.锥形瓶 g.玻璃棒 h.药匙 i.烧瓶
(2)实验中KMnO4溶液应装在___式滴定管中,原因是___。
(3)滴定过程中用去VmLamol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为__mol·L-1,由此可计算x的值为___。
(4)若滴定终点读数时俯视,则计算出的x值可能__(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,V升容器中加入a mol HI使之分解:2HI(g) ![]() H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
A. 减压时,v(逆)增大,v(正)减小,平衡向逆反应方向移动
B. 若加入2a mol HI,则平衡常数变为2倍
C. 加压时,v(逆)、v(正)均不变,平衡不移动
D. 若保持压强不变,通入氦气,则v(逆)、v(正)均减小,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com