
�ȣ�Sr��Ϊ�������ڢ�A��Ԫ�أ��仯������ˮ�Ȼ��ȣ�SrCl2��6H2O����ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ��������������£�
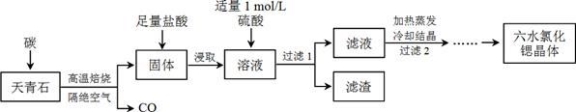
��֪���� �������ȡ����Һ�г�����Sr2+��Cl���⣬����������Ba2+���ʣ�
�� SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10��7��1.1��10��10��
�� ��ˮ�Ȼ��Ⱦ���61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
��1������ʯ����ǰ����ĥ���飬��Ŀ����_________________________________________��
��2������ʯ��̼�����������±���ʱ SrSO4��ֻ��S����ԭ����1 mol SrSO4��Ӧ����ת��8 mol���÷�Ӧ�Ļ�ѧ����ʽ_____________________________________________��
��3������������ ����д��ѧʽ��
��4��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬������2�����辭����ϴ�ӣ�����IJ�����
�� ϴ���Ȼ��Ⱦ������ѡ�ñ����Ȼ�����Һ����ԭ���� ��
�� ��ҵ�����ȷ紵����ˮ�Ȼ��ȣ�ѡ��������¶ȷ�Χ�� ������ĸ����
A��50~60�� | B��70~80�� | C��80~100�� | D��100������ |
��5����Ʒ���ȼ�⣺��ȡ1.000 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 1.100��10��2mol��AgNO3��Һ����ʱ��Һ�г�Cl�D�⣬����������Ag+��Ӧ�����ӣ�����Cl�D��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000 mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+ ��AgSCN��ɫ��������ʽ�������ζ��ﵽ�յ��������________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�ɶ��и�һ��4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У��Ⱥ������Ӽ��ֺ��зǼ��Թ��ۼ����ǣ� ��
A��HClO B��Ba��OH��2 C��Na202 D��Ar
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�ɶ��и߶���4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������ȷ���ǣ� ��
A����ҵ�ϵ�ⱥ��ʳ��ˮ��������ӦΪ��2Cl����2e���TCl2��
B��������Ƕп�飬п���������Է����屻��ʴ
C������������ʴ��������ӦΪ��O2+2H2O+4e���T4OH��
D������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ����ѧ���и߶���3���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���в����γ���λ��������ǣ� ��
A��Ag+��NH3 B��BF3��NH3 C��Co3+��H2O D��Ag+��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ����ѧ���и߶���3���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���ǣ� ��
A. ��̬ԭ���Ǵ����������״̬��ԭ��
B. ��̬Cԭ�ӵĵ����Ų�ʽ��1s22s12p3
C. ��ɫ��Ӧ�ǽ���ԭ�ӵĵ��Ӵӻ�̬ԾǨ������̬ʱ�����Ĺ���
D. ͬһԭ�Ӵ��ڼ���̬ʱ������һ�����ڻ�̬ʱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ���ص���ѧЭ����߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���л������У��˴Ź�������ֻ����������ҷ����֮��Ϊ3��2���ǣ� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ���ص���ѧЭ����߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵ�����þ������ϣ�ȡ�������û�����ķݣ��ֱ�ӵ�������������Һ�У���ַ�Ӧ�ų����������ǣ� ��
A��3 mol��L��1 HCl B��4 mol��L��1 HNO3
C��8 mol��L��1 NaOH D��18 mol��L��1 H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ȫ����ͨ�ߵ�ѧУ����ͳһ���Ի�ѧ����������棩 ���ͣ������
�����Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
��1����������ȣ�������Ϊȼ�ϵ��ŵ���_________(���ٴ������)����������ֱ��ȼ�յ�����ת����Զ����ȼ�ϵ�أ�д����������ȼ�ϵ�صĸ�����Ӧʽ��____________��
��2�������������Ʊ�H2O2����֪��
H2(g)+A(l)=B(l) ��H1
O2(g)+B(l)=A(l)+H2O2(l) ��H2
����A��BΪ�л������Ӧ��Ϊ�Է���Ӧ����H2(g)+ O2(g)= H2O2(l)�Ħ�H____0(���������<����=��)��
��3���ں��º��ݵ��ܱ������У�ij���ⷴӦ��MHx(s)+yH2(g) MHx+2y(s) ��H<0�ﵽ��ѧƽ�⡣�����й�������ȷ����________��
MHx+2y(s) ��H<0�ﵽ��ѧƽ�⡣�����й�������ȷ����________��
a������������ѹǿ���ֲ���
b������y mol H2ֻ��1 mol MHx
c�������£��÷�Ӧ��ƽ�ⳣ������
d������������ͨ��������������v(����)��v(����)
��4������̫����ֱ�ӷֽ�ˮ���⣬�����������������;����������ת����ʽΪ_______��
��5�����������ĸ�����Ҳ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ���������Fe+2H2O+2OH? FeO42?+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42?�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42?+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42?�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
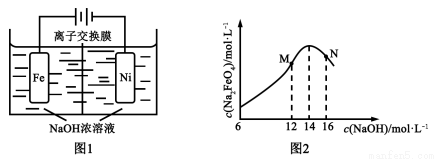
�ٵ��һ��ʱ���c(OH?)���͵�������_______(������ҡ��������ҡ�)��
�ڵ������У��뽫�������������弰ʱ�ų�����ԭ����_______��
��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ȫ����ͨ�ߵ�ѧУ����ͳһ���Ի�ѧ���¿α�2������棩 ���ͣ�ѡ����
ij��ɫ��ĩ������������ɣ�Ϊ������ɷֽ�������ʵ�飺
��ȡ������Ʒ��������ˮ���в��ֹ���δ�ܽ⣻�ټ�������ϡ���ᣬ�����ݲ���������ȫ���ܽ⣻
��ȡ������Ʒ��������ϡ���������ݲ����������й�����ڡ�
�ð�ɫ��ĩ����Ϊ
A��NaHCO3��Al(OH)3
B��AgCl��NaHCO3
C��Na2SO3��BaCO3
D��Na2CO3��CuSO4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com