
【题目】分部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
① | A | A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体 |
② | B | B是一种常见金属,原子核外有三个电子层且最外层电子为偶数 |
③ | C | C的气态氢化物易液化常作制冷剂 |
④ | D | D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
⑤ | E | E原子最外层电子数是内层电子总数的3倍 |
⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为______________,离子半径:B2+_________C3-(填"大于、小于或等于”)。
(2)简单气态氢化物的热稳定性:D__________E(填"大于、小于或等于”)。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为__________,N的结构式为___________。
(4)用化学方程式表明C与E这两种元素的非金属性的强弱_________________。
【答案】(1)第四周期、第VIII族;小于;(2)小于
(3)①分别取少许X、Y于试管中,各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象是H2O
②![]() ;
;![]() ;
;
(4)4NH3+3O2=2N2+6H2O
【解析】试题分析:A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体,A为Fe元素;B是一种常见金属,原子核外有三个电子层且最外层电子为偶数,B为Mg元素;C的气态氢化物易液化常作制冷剂,C为N元素;D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料,D为Si元素;E原子最外层电子数是内层电子总数的3倍,E为O元素;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,F为H元素。
(1) A为Fe元素,在周期表中位于第四周期、第VIII族,镁离子和氮离子核外电子排布相同,核电荷数越大,离子半径越小,离子半径:Mg2+小于N3-,故答案为:第四周期、第VIII族;小于;
(2)元素的非金属性越强,简单气态氢化物的热稳定性越强,热稳定性:硅烷小于水,故答案为:小于;
(3)①双氧水在二氧化锰作用下回分解放出氧气,因此区别水与双氧水的水溶液的实验方法是分别取少许X、Y于试管中,各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象是H2O,故答案为:分别取少许X、Y于试管中,各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象是H2O;
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M为氨气,电子式为![]() ,N为肼,结构式为
,N为肼,结构式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)氨气能够在纯氧中燃烧生成氮气,说明氧元素的非金属性比氮元素强,反应的方程式为4NH3+3O2=2N2+6H2O,故答案为:4NH3+3O2=2N2+6H2O。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质的性质比较,正确的是( )
A. 酸性:H2SO4﹤HClO B. 气态氢化物稳定性:HCl>H2S
C. 离子半径:Na+>F- D. 碱性:NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
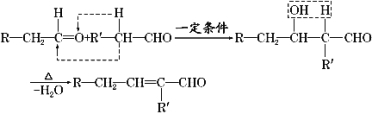
【题目】醛在有机合成中十分重要,已知如下反应:
由枯茗醛合成兔耳草醛的传统合成路线如图所示:
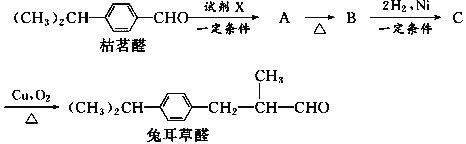
(1)写出试剂X的结构简式:__________________。
(2)写出有机物B的结构简式:__________________________。
(3)写出有机物C →兔耳草醛的化学方程式:________________________。
(4)人们最新研究的兔耳草醛的合成路线,该路线原子利用率理论上可达100%:

试写出D的结构简式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的环上只存在一种化学环境的氢原子。写出Y所有可能的结构简式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池和电解池的比较中正确的是
A.能量转化形式相同
B.两极的名称相同
C.负极和阴极上移向的离子类别相同
D.负极和阳极上发生的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A原子核中无中子且A和C同主族,A和B形成的化合物在水中呈碱性,单质D在单质E中可燃烧产生白色烟雾。回答下列问题:
(1)除B外,上述元素的电负性从大到小依次为 ;(用元素符号表示)
(2)B的氢化物与同主族第三、第四周期所形成的氢化物沸点由高到低的排列顺序是 (用化学式表示),原因是 ;
(3)A和D形成的化合物的中心原子的杂化类型为 ;A和B形成的化合物BA5中存在的化学键类型为 ;
(4)单质D的一种含氧酸可表示为H3DO3,它是二元弱酸,请写出它与足量的氢氧化钠溶液反应的离子方程式____________;
(5)C 的一种氧化物的晶胞结构如图所示,晶胞参数a=0.566 nm,晶胞中C原子的配位数为 ;此晶体的密度(g·cm-3)为 (只列式不计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关材料分类不正确的是
A.玻璃、水泥、陶瓷属于传统的无机非金属材料
B.聚氯乙烯属于有机材料
C.光导纤维属于新型无机非金属材料
D.玻璃钢属于金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X→甲(g),Y+Z→乙(g)。甲为10电子分子,Z为黄绿色气体。甲、乙可化合生成离子化合物。
(1)X 的电子式是______________。
(2)写出Y+X→甲(g)的化学方程式_____________________。
(3)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入或通入某纯净物(从X、Y、Z、甲、乙中选择),即可生成白色沉淀,该纯净物的化学式为________,生成的白色沉淀的化学式为___________。
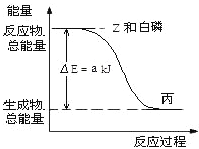
(4)已知常温下,PCl3为液体,PCl5为固体。白磷(P4)在Z气体中燃烧生成液态丙分子,白磷固体和 Z 气体反应,生成1 mol液态丙时,能量变化如图所示,写出该反应的热化学方程式_______________。
已知1 mol白磷固体和Z气体反应,生成固态丁时,放热b kJ,则1 mol固态丁转化为液态丙时的反应热ΔH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生如下分解:
[UO2(NO3)2]―→UxOy+NO2↑+O2↑(未配平)
将气体产物收集于试管中并倒扣于盛水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是( )
A.UO2 B.2UO2·UO3
C.UO3 D.UO2·2UO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取浓度均为0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。将浓度均为0.1mol/L、体积均为1L的HA溶液和HB溶液分别加水稀释至体积为VL,溶液pH的变化曲线如图所示,则下列说法正确的是

A.HA是强酸,HB是弱酸
B.X是HB,Y是HA
C.常温下,pH相等的NaA溶液与NaB溶液的物质的量浓度:c(NaA)<c(NaB)
D.NaA与NaB的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(HA)+c(HB)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com