
分析 (1)FeCl3溶液用于腐蚀印刷铜板,反应生成氯化铜、氯化亚铁;
(2)SO2气体通入FeCl3溶液中,发生氧化还原反应生成硫酸亚铁、盐酸;
(3)Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,为氧化还原反应,还生成氯化钾;
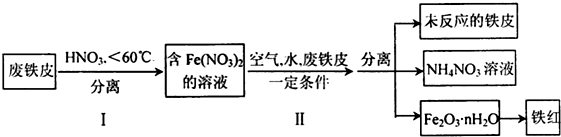
(4)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红,
①Fe过量,与硝酸反应生成硝酸亚铁、NO和水;
②根据反中的元素的化合价的变化判断还原剂,根据电子得失守恒计算被还原的硝酸;
③铵根离子与碱反应生成氨气;
④铁与硝酸铁反应生成硝酸亚铁;
⑤根据流程图可知,生产结束后氮元素主要存在硝酸铵溶液中.
解答 解:(1)FeCl3溶液用于腐蚀印刷铜板,反应生成氯化铜、氯化亚铁,离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)SO2气体通入FeCl3溶液中,发生氧化还原反应生成硫酸亚铁、盐酸,离子反应为SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(3)Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,为氧化还原反应,还生成氯化钾,离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;
(4)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红,
①Fe过量,与硝酸反应生成硝酸亚铁、NO和水,反应为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,故答案为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
②反应4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3中,铁元素的化合价从+2价升到+3价,所以反应的还原剂是4Fe(NO3)2,根据反应4Fe+10HNO3═4Fe(NO3)2+NH4NO3+3H2O可知,氮从+5价降到-3价,反应中共转移8个电子,所以每生成1molNH4NO3,被还原的硝酸的物质量是1mol,
故答案为:Fe(NO3)2;1mol;
③铵根离子与碱反应生成氨气,则NH4+离子检验方法为向硝酸铵溶液中加入氢氧化钠溶液,用酒精灯加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明原溶液中含有铵根离子,反之则无,发生离子反应为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:向硝酸铵溶液中加入氢氧化钠溶液,用酒精灯加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明原溶液中含有铵根离子,反之则无;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
④铁与硝酸铁反应生成硝酸亚铁,则Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入铁粉,故答案为:铁粉;
⑤根据流程图可知,生产结束后氮元素主要存在硝酸铵溶液中,故选b.
点评 本题考查较综合,涉及氧化还原反应、离子反应及物质的制备流程等,为高频考点,侧重分析能力及计算能力的考查,把握化学反应原理及制备流程的分析为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水所含分子数目为NA | |
| B. | 常温常压下,23g NO2和23g N2O4所含原子数目均为1.5NA | |
| C. | 标准状况下,22.4L氦气(He)与22.4L氟气(F2)所含原子数均为2NA | |
| D. | 18g D2O所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
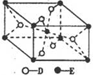 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.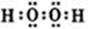 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4、Fe(NO3)3; Fe2(SO4)3、HNO3、N2O、H2O | |
| B. | HNO3、FeSO4; Fe2(SO4)3、Fe(NO3)3、N2O、H2O | |
| C. | HNO3、Fe2(SO4)3; FeSO4、Fe(NO3)3、N2O、H2O | |
| D. | Fe2(SO4)3、N2O; FeSO4、HNO3、Fe(NO3)3、H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com