
【题目】七水硫酸镁(MgSO4·7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
表2两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
硼镁泥制取七水硫酸镁的工艺流程如下

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施_______________。
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式span>_____________________
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:__________________。
(4)加入硼镁泥调节pH=5~6目的是________________。
(5)得到的沉淀C的组成是_________________(填化学式),过滤Ⅲ需趁热过滤,原因是___________。
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是____________。
【答案】 加热、搅拌或将固体粉碎(任写两条) H3BO3+H2O![]() H++[B(OH)4]- Mn2+ +ClO-+H2O = MnO2↓+2H++Cl- 使溶液中的Al3+和Fe3+完全转化为沉淀而折出 CaSO4 2H2O或CaSO4 趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出 取过滤Ⅱ后的溶液1 ~2ml 丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+、否则无。(其它和理答案都给分)
H++[B(OH)4]- Mn2+ +ClO-+H2O = MnO2↓+2H++Cl- 使溶液中的Al3+和Fe3+完全转化为沉淀而折出 CaSO4 2H2O或CaSO4 趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出 取过滤Ⅱ后的溶液1 ~2ml 丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+、否则无。(其它和理答案都给分)
【解析】试题分析:(1)根据影响速率的因素,加热、搅拌或将固体粉碎都能加快酸溶速度;(2) 根据硼酸为一元弱酸,其酸性不来源于羟基的电离,硼酸电离方程式为H3BO3+H2O![]() H++[B(OH)4]- ;(3) MnO中锰元素化合价为+2,MnO2中锰元素化合价为+4,锰元素被次氯酸钠氧化为MnO2;Mn2+ +ClO-+H2O = MnO2↓+2H++Cl- ; (4)根据流程,调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出;(5)温度越高,硫酸钙的溶解度越小,;(6) KSCN溶液检验Fe3+;
H++[B(OH)4]- ;(3) MnO中锰元素化合价为+2,MnO2中锰元素化合价为+4,锰元素被次氯酸钠氧化为MnO2;Mn2+ +ClO-+H2O = MnO2↓+2H++Cl- ; (4)根据流程,调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出;(5)温度越高,硫酸钙的溶解度越小,;(6) KSCN溶液检验Fe3+;
解析:(1)根据影响速率的因素分析;(2) 根据硼酸为一元弱酸,其酸性不来源于羟基的电离,分析电离方程式;(3) MnO中锰元素化合价为+2,锰元素被氧化为+4; (4)根据流程,调节pH=5~6目的是除去杂质离子;(5)温度越高,硫酸钙的溶解度越小,趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出;(6) 取过滤Ⅱ后的溶液1 ~2ml 丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+、否则无。


科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)电解食盐水的过程中,氧化产物是____________________,用双线桥表示出电子转移的方向和数目________________,题干中反应改写成离子方程式是_____________。
(2)实验室用______________溶液(填化学式)处理多余的氯气,避免污染环境,写出化学方程式___________________________________________________。
(3)电解食盐水要求对粗食盐水进行精制,以除去粗食盐水中含有的泥沙和SO42-、Ca2+、Mg2+等杂质离子。精制时依次加入BaCl2溶液、Na2CO3、NaOH,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
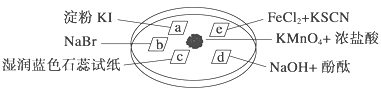
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极__________________________ ;负极_________________________。
②图中X溶液是_______________,Y溶液是__________________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。

①甲池中OH-移向__________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________。
③乙池中总反应的离子方程式___________________。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
(1)基态钛原子的价电子排布图为__________________;基态铝原子核外电子分布在____个能级上。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是______________________。
(3)FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是________________________________。
(4)煅烧铁矿石常会生成SO2,SO2为_______分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为_______________。
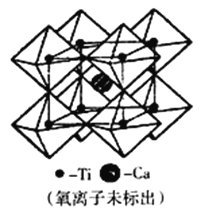
(5)钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被_____个氧离子包围。钙钛矿晶体的化学式为________________________。若该晶胞的边长为apm,则钙钛矿晶体的密度为_____________g·cm-3(用NA表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是( )
实验目的 | 实验方案 | |
A | 检验FeSO4晶体是否已氧化变质 | 将FeSO4样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
B | 探究浓度对化学反应速率的影响 | 取两支试管,各加入4mL0.5mol/L的KMnO4酸性溶液,然后向两支试管中分别加入2mL0.1mol/LH2C2O4(草酸)溶液和2mL0.2mol/LH2C2O4溶液比较反应褪色的快慢 |
C | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相中的水 |
D | 判断淀粉是否水解 | 向用稀硫酸作催化剂的淀粉水解液中加入适量银氨溶液后水浴加热,观察是否产生银镜 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com