
| A、0.1mol;13% |
| B、0.1mol;26% |
| C、0.2mol;26% |
| D、0.2mol;74% |
| 0.148mol |
| 0.2mol |


科目:高中化学 来源: 题型:
| A、在含铁元素较多的酸性土壤中 |
| B、与电源负极相连后埋在地下 |
| C、在潮湿疏松的碱性土壤中 |
| D、在含碳粒较多、潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓是与内能有关的物理量,当反应在恒压条件下进行时,反应热效应等于焓 |
| B、当能量变化以热的形式表现时,将反应分为放热反应和吸热反应 |
| C、测定中和反应反应热时,为提高实验准确性,使用稍过量的碱 |
| D、新能源有太阳能、氢能、风能、生物质能等,它们都是可再生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液能导电,所以氯化钠溶液是电解质 |
| B、化合反应不一定是氧化还原反应 |
| C、盐、碱一定含有金属元素 |
| D、在水溶液中电离产生H+的化合物一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
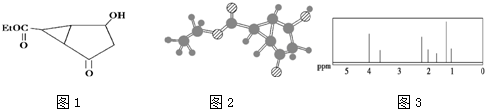
| A、该有机物中只含有酯基、羰基、羟基三种官能团 |
| B、该有机物不能发生加成反应 |
| C、该有机物的化学式是C8H10O4 |
| D、该有机物中-Et代表-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-=CaCO3↓+2H2O |
| B、向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、氯化亚铁溶液中通入氯气 Fe2++Cl2=Fe3++2Cl- |
| D、苛性钾溶液中加入稀醋酸 H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用金属钠可区分乙醇和乙醚 |
| B、用高锰酸钾酸性溶液可区分苯和甲苯 |
| C、用水可区分苯和溴苯 |
| D、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相同的NH4Cl溶液和(NH4)2SO4溶液,二者的pH相等 |
| B、pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-) |
| C、0.1 mol?L-1的醋酸的pH=a,0.01 mol?L-1的醋酸的pH=b,则a+1>b |
| D、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2>Q3 |
| B、参加反应的H2、Cl2总能量大于生成物HCl的总能量 |
| C、Q1+Q2<2Q3 |
| D、参加反应的H2、Cl2总能量小于生成物HCl的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com