
下列萃取与分液结合进行的操作(用CCl4为萃取剂,从碘水中萃取碘)中错误的是
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:选择题
在元素周期表中,与元素的周期数、主族序数相同的分别是该元素原子的
①质子数 ②核电荷数 ③电子层数 ④原子序数 ⑤最外层电子数
A.①⑤ B.②③ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期中化学试卷(解析版) 题型:选择题
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:填空题
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
__________________________________________________________________________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应热△H3_____0(填“>”、“<”或“=”),该反应的平衡常数表达式为______________________________________________________。
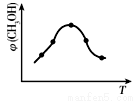
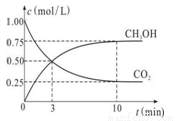
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。试回答:0~10 min内,氢气的平均反应速率为_________mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数_________(填“变大”、“减少”或“不变”)。
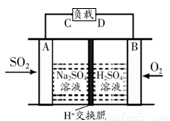
(3)脱硫。①有学者想利用如右图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则电子流出的电极为_____(用A或B表示),A极的电极反应式为______________________________。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为_________________________;常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH_____7(填写“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A.46g NO2 和N2O4以任意比混合,所得混合气体中氧原子数2NA
B.标准状况下,含NA 个共价键的HF分子所占的体积约为22.4 L
C.1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA
D.2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数小于2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二4月月考化学试卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O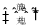 Fe(OH)2+2Ni(OH)2。下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2。下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省厦门市高二下学期期中考试化学试卷(解析版) 题型:实验题
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。该反应的离子方程式为2MnO4- + 5H2C2O4+ 6H+===2Mn2+ +10CO2+8H2O
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
某同学进行实验,实验装置如下左图。其中A、B的成分见下右表
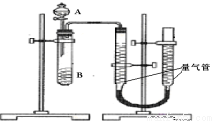

(1)该实验的目的是_______________________________________________。
(2)实验开始前需要检查气密性。分液漏斗中A溶液应该______________加入(填“一次性”或“逐滴滴加”)(3)完成该实验还需要__________(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平。
(4) 请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图。

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5 mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
0.2 mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | --- |
(5)X=____________,4号实验中始终没有观察到溶液褪色,你认为可能的原因是__________________________________。
(6)2号反应中,H2C2O4的反应速率为____________________________。
(7)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,你得出的结论是_____________________________。
(8)从影响化学反应速率的因素看,你的猜想还可能是______________________的影响。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省莆田市高二下学期期中化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是 ( )
标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com