
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4mol/L的苛性钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(3)另取10mL原溶液,加入1.92g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(4)向(3)反应后的溶液中加入多少毫升1mol/L硫酸就能将1.92g铜恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源:2010—2011学年上海交通大学附属中学高一第二学期期末化学试卷 题型:计算题
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4mol/L的苛性钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(3)另取10mL原溶液,加入1.92g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(4)向(3)反应后的溶液中加入多少毫升1mol/L硫酸就能将1.92g铜恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源:2013届上海交通大学附属中学高一第二学期期末化学试卷 题型:计算题
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4mol/L的苛性钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(3)另取10mL原溶液,加入1.92g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(4)向(3)反应后的溶液中加入多少毫升1mol/L硫酸就能将1.92g铜恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市浦口区江浦高级中学高三(上)期中化学试卷(解析版) 题型:填空题
 CuO
CuO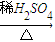 CuSO4
CuSO4 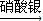 Cu(NO3)2
Cu(NO3)2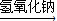 Cu(OH)2
Cu(OH)2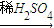 CuSO4
CuSO4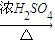 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.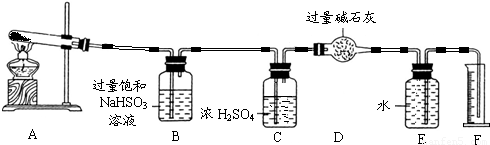
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com