
下列有关氧化还原反应的说法正确的是( )
A.浓盐酸在化学反应中既可以作氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu + H2SO4====CuSO4+ H2↑
D.亚氯酸可发生分解反应:HClO2→ClO2↑+Cl2↑+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol
科目:高中化学 来源: 题型:
下列叙述错误的是
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
①请根据XeF4的结构示意图(图1)判断这个分子是 (填极性分子或非极性分子)。
②XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体__________;
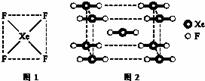
③一个XeF2晶胞中实际拥有XeF2_______个。
(2)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为 ,1 mol乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
A.原子半径由小到大的顺序:X< Y < Z< W
B.Z的最高价氧化物能与水反应生成相应的酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1) 工业上用A和B的单质化合制备化合物X,该反应的化学方程式
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式
(4)用电子式表示化合物D2F的形成过程 。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种酸性溶液中,可能存在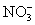 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于平衡常数的说法正确的是( )
A.在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度
B.在任何条件下,化学平衡常数是一个恒定值
C.平衡常数的大小与温度、浓度、压强、催化剂等无关
D.从平衡常数的大小可以推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.Na2CO3溶液显碱性: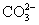 +2H2O
+2H2O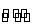 H2CO3+2OH-
H2CO3+2OH-
B.碳酸氢钠溶液中加入足量的烧碱溶液: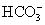 +OH-====
+OH-====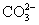 +H2O
+H2O
C.金属钠与水反应:Na+H2O====Na++OH-+H2↑
D.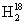 O中投入Na2O2:2
O中投入Na2O2:2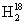 O+2Na2O2====4Na++4OH-+18O2↑
O+2Na2O2====4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
氮及其化合物的变化关系如下图所示。
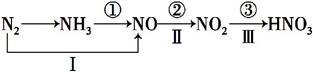
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.氮气可在足量的氧气中通过一步反应生成NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com