
| A、0.3 mol/L |
| B、0.03 mol/L |
| C、0.5 mol/L |
| D、0.05mol/L |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 浓硫酸 |
B、 白磷 |
C、 四氯化碳 |
D、 硝酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
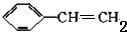 ,将ag聚苯乙烯树脂溶于bg苯中,然后通入 cmol乙炔气体,则充分混合后,所得产物中C、H两种元素的质量比是( )
,将ag聚苯乙烯树脂溶于bg苯中,然后通入 cmol乙炔气体,则充分混合后,所得产物中C、H两种元素的质量比是( )| A、12:1 | B、6:1 |
| C、8:3 | D、1:12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,11.2L SO3所含的分子数目为0.5 NA |
| B、室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA |
| C、铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA |
| D、8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量-27) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ |
| B、向Na2CO3饱和溶液中通入过量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O |
| D、向偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com