
分析 Wg该混合物在H2流中加热,充分反应后,减少的质量为混合物中氧元素的质量,则混合物中含有氧元素的物质的量为:$\frac{5.6g}{16g/mol}$=0.35mol;
另取Wg该混合物用足量的稀硫酸溶解,反应生成硫酸铜和硫酸铁,之后加入50g铁屑,反应共生成1.12L(标准状况)气体,该气体为氢气,滤出固体残留物并洗涤,烘干,称的其质量为42g,该残留物为Fe和Cu的混合物,固体加入的铁屑的质量减少了(50-42)g=8g,反应前后固体质量变化的原因为:生成氢气消耗Fe、与铁离子反应消耗铁及Fe与铜离子反应生成铜的质量差,设原混合物中CuO和Fe2O3的物质的量分别为x、y,根据氧元素守恒可知:x+3y=0.35,根据加入铁屑后固体质量变化可得:56(y+$\frac{1.12L}{22.4L/mol}$)-8x=8,据此进行计算出氧化铜、氧化铁的物质的量,再根据m=nM计算出混合物总质量,从而可计算出原混合物中氧化铁的质量分数.
解答 解:取W g该混合物在H2流中加热,充分反应后,得到的残留固体的质量为(W-5.6)g,减少的质量为混合物中氧元素的质量,则混合物中含有氧元素的物质的量为:$\frac{5.6g}{16g/mol}$=0.35mol;
另取W g该混合物用足量的稀硫酸溶解,反应生成硫酸铜和硫酸铁,之后加入50g铁屑,反应共生成1.12L(标准状况)气体,该气体为氢气,滤出固体残留物并洗涤,烘干,称的其质量为42g,该残留物为Fe和Cu的混合物,固体加入的铁屑的质量减少了(50-42)g=8g,反应前后固体质量变化的原因为:生成氢气消耗Fe、与铁离子反应消耗铁及Fe与铜离子反应生成铜的质量差,
设原混合物中CuO和Fe2O3的物质的量分别为x、y,
根据氧元素守恒可知:x+3y=0.35,
根据加入铁屑后固体质量变化可得:56(y+$\frac{1.12L}{22.4L/mol}$)-8x=8,
联立解得:x=0.05mol、y=0.1mol,
则原混合物中含有氧化铁的物质的量为0.1mol,质量为:160g/mol×0.1mol=16g,
原混合物中含有氧化铜的质量为:80g/mol×0.05mol=4g,
所以原混合物中氧化铁的质量分数为:$\frac{16g}{16g+4g}$×100%=80%,
答:混合物中Fe2O3的质量分数为80%.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后前后质量不会的根本原因为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Cl-、NO3-、Fe3+ | |
| B. | 能使甲基橙显红色的溶液:CO32-、Na+、Cl-、SO42- | |
| C. | pH=1的溶液中:Mg2+、SO42-、Fe2+、Cu2+ | |
| D. | 能使铝钝化的溶液中:Ba2+、Na+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
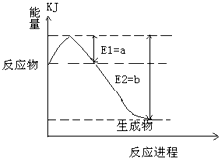 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义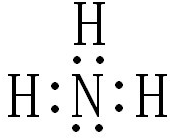
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 前三种均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
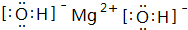 (写电子式).
(写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”计算机芯片的材料是二氧化硅 | |
| B. | “人造太阳”原理为:21H+31H→42He+10n,该过程不是化学变化 | |
| C. | “84”消毒液的有效成分是Ca(ClO)2 | |
| D. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀盐酸清洗装石灰水的试剂瓶:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 用稀盐酸清洗试管中的二氧化锰:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O | |
| C. | 用稀硝酸溶解试管中的银镜:3Ag+NO3-+4H+═3Ag++NO↑+2H2O | |
| D. | 用稀硫酸清洗试管中的氧化铜:CuO+2H+═Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com