
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 | |
| D. | 元素的第一电离能:Al<Si |
分析 A、镁的3s轨道是全充满,能量低比较稳定.
B、同一主族元素,其第一电离能、电负性随着原子序数的增大而减小;
C、Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子;
D、同一周期,从左向右元素第一电离能整体呈增大趋势,注意第ⅡA、ⅤA反常.
解答 解:A、镁的3s能级有2个电子,轨道是全充满,能量低比较稳定,所以镁元素的第一电离能高于同周期相邻元素Al的第一电离能,故A正确;
B、同一主族元素,其第一电离能、电负性随着原子序数的增大而减小,所以锗的第一电离能、电负性都低于碳,故B错误;
C、Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,故C正确;
D、同一周期,从左向右元素第一电离能整体呈增大趋势,其中第ⅡA、ⅤA由于处于半满和全满的稳定结构反常,所以第一电离能:Al<Si,故D正确.
故选:B.
点评 本题考查元素周期律知识,涉及电子排布、第一电离能、电负性比较等知识,为高考高频考点,侧重于学生分析能力的考查,注意把握元素周期律的递变规律,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 燃烧法是确定有机物成分的有效方法之一 | |
| C. | 红外光谱通常用于分析有机物的相对分子质量 | |
| D. | 核磁共振氢谱的研究有助于确定有机物分子中氢原子的类型和数目比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
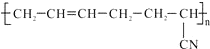 ,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )| A. | ①③⑤ | B. | ①③ | C. | ①④⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
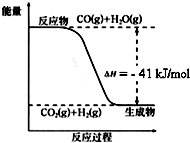 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Wn+、Xm+、Ym-、Zn-的离子半径依次增大 | |
| B. | Y、Z的气态氢化物的热稳定性:HmY>HnZ | |
| C. | W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 | |
| D. | W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  将NO2球浸泡在冷水中和热水中 | |
| B. | 排饱和食盐水收集氯气 | |
| C. | 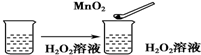 | |
| D. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3△H<0工业合成氨,通常选择高压的条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com