
分析 短周期主族元素A、B、C、D的原子序数依次增大,其中只有C为金属元素,C的最外层电子数和A的最外层电子数相等,则C为Na、A为H;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,设B的质子数为x,D的质子数为y,则(11+y)=(1+x)×3,则3x=8+y,2<x<9,11<y<17,则x=8,y=16符合,即B为O,D为S,以此来解答.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,其中只有C为金属元素,C的最外层电子数和A的最外层电子数相等,则C为Na、A为H;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,设B的质子数为x,D的质子数为y,则(11+y)=(1+x)×3,则3x=8+y,2<x<9,11<y<17,则x=8,y=16符合,即B为O,D为S,
(1)由上述分析可知,A、B、C、D分别为H、O、Na、S,故答案为:H;O;Na;S;
(2)由A、B、C、D四种原子可以形成两种化合物为硫酸氢钠、亚硫酸氢钠,二者发生的离子反应为H++HSO3-=SO2↑+H2O,故答案为:H++HSO3-=SO2↑+H2O;
(3)A和C形成的化合物NaH的电子式为Na+[:H]-,故答案为:Na+[:H]-.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素等为解答的关键,侧重分析与推断能力的考查,注意周期律及元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol/(L•min) | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 若在恒容时充入与反应无关的气体Ar,由于增大了容器内的压强,而加快了反应速率 | |
| D. | 当B的消耗速率与C的消耗速率相等时,反应达到了平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
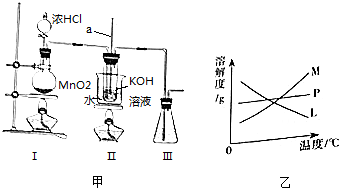
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
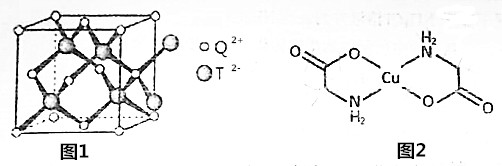
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com