
| Q | X | Y | ||
| M | W | Z |
| A�� | ��ͬ�����£�QԪ����ͼۼ��⻯����ͬ����Ԫ�����⻯��е���ߵ� | |
| B�� | ����W3X4�У�ÿ��ԭ���������ﵽ8�����ȶ��ṹ | |
| C�� | X��Q��Y�����γɵĻ������п��ܼ������Ӽ������й��ۼ� | |
| D�� | ��Q�����������ֱ�ͨ��W������Һ��M������Һ�о��ɲ�����ɫ���� |
���� W��X��Y��ZΪ������Ԫ�أ���Ԫ�������ڱ���λ�ÿ�֪��X��Y���ڵڶ����ڣ�W��Z���ڵ������ڣ���W������������Ϊa����X��Y��Z�����������ֱ�Ϊa+1��a+2��a+3����a+a+1+a+2+a+3=22�����a=4����WΪSi��XΪN��YΪO��ZΪCl��QΪC��MΪAl���Դ������
��� �⣺W��X��Y��ZΪ������Ԫ�أ���Ԫ�������ڱ���λ�ÿ�֪��X��Y���ڵڶ����ڣ�W��Z���ڵ������ڣ���W������������Ϊa����X��Y��Z�����������ֱ�Ϊa+1��a+2��a+3����a+a+1+a+2+a+3=22�����a=4����WΪSi��XΪN��YΪO��ZΪCl��QΪC��MΪAl��
A��QΪC�����鲻�������ͬ��Ԫ�ص��⻯������Է���������ķе�ߣ������ķе���ͣ���A����
B��Si3N4��SiΪ+4�ۣ�NΪ-3�ۣ���Ԫ�ػ��ϼ۾���ֵ+ԭ�ӵ�����������=8��ÿ��ԭ���������ﵽ8�����ȶ��ṹ����B��ȷ��
C��X��Q��Y�����γɵĻ�����̼������м������Ӽ������й��ۼ�����C��ȷ��
D��������̼���������Һ��ƫ��������Һ��Ӧ�����ɰ�ɫ��������D��ȷ��
��ѡA��
���� ���⿼��λ�á��ṹ�����ʵĹ�ϵ��Ϊ��Ƶ���㣬����Ԫ�ص�λ�á�ԭ��������ϵ�ƶ�Ԫ��Ϊ���Ĺؼ������ط�����Ӧ���������Ŀ��飬ע��е�ȽϷ�����Ԫ�ػ�����֪ʶ��Ӧ�ã���Ŀ�ѶȲ���


 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ�������ĵ缫Ϊԭ��ص����� | |
| B�� | �������϶���ʯī����ϡ�������������Һ | |
| C�� | �������Һ�е���������ͨ�����ĵ缫�ƶ� | |
| D�� | ͨ�����ĵ缫��ӦʽΪCl2+2e-�T2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -OH��OH-������ͬ�������� | |
| B�� | ����������Һ�м���������Һ��һ����ͻῴ�������������� | |
| C�� | �����Ҵ����Ƿ���ˮ������ˮ����ͭ | |
| D�� | ij�л�����������ȼ������CO2��H2O������л���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �¹���ά�� | B�� | ���ı�������˹ | ||
| C�� | �¹������ϣ | D�� | �������ĺ�ά�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.01mol ����-CH3������������Ϊ0.07NA | |
| B�� | ��״���£�2.24L CH3Cl������������Ϊ0.1NA | |
| C�� | ���³�ѹ�£�0.1mol/L CH3CH2OH��Һ�к��е�̼ԭ����ĿΪ0.2NA | |
| D�� | 10 mL 0.1 mol/L HCHO��Һ��������������Һ��ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ2��10-3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӹ��������ˮ�Ե�ֲ����ά������ʳƷ����� | |
| B�� | ʯ���ѽ⡢ú�ĸ��������ƴ��������ʵı��Ժ����������ӵľۼ����ǻ�ѧ�仯 | |
| C�� | �Ե���Ϊԭ�Ͽ���ȡ�������� | |
| D�� | ʳ�û����ͺͼ����嶼�ܷ���ˮ�ⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
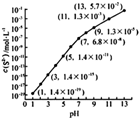 ��1������ˮ��Һ�������ԣ���ԭ��ΪNH3•H2O?NH4++OH-�������ӷ���ʽ��ʾ����0.1�İ�ˮ�м���������NH4Cl���壬��Һ��pH���ͣ�����ߡ����͡�������������������������Һ�е�NH4+��Ũ���������������С������
��1������ˮ��Һ�������ԣ���ԭ��ΪNH3•H2O?NH4++OH-�������ӷ���ʽ��ʾ����0.1�İ�ˮ�м���������NH4Cl���壬��Һ��pH���ͣ�����ߡ����͡�������������������������Һ�е�NH4+��Ũ���������������С������| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-8 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com