
| A. | 核外有25个电子 | |
| B. | 是一种新元素 | |
| C. | 核内有15个质子,核外有10个电子 | |
| D. | 质量数为25,原子序数为15,核内有10个中子 |
分析 A.元素符号的左下角是质子数,原子质子数=核外电子数;
B.是磷元素的一种新原子;
C.原子核内质子数=核外电子数;
D.元素符号的左下角表示质子数,质子数=原子序数,左上角表示质量数,质量数-质子数=中子数.
解答 解:A.${\;}_{15}^{25}$P元素符号的左下角15表示其质子数,原子的核外电子数=质子数=15,故A错误;
B.元素的种类由质子数决定,${\;}_{15}^{25}$P表示磷元素,不是新元素,是磷元素的新原子,故B错误;
C.${\;}_{15}^{25}$P元素符号的左下角15表示其质子数,核内有15个质子,原子核内质子数=核外电子数,核外有15个电子,故C错误;
D.${\;}_{15}^{25}$P元素质量数为25,原子序数为15,质量数-质子数=中子数=25-15=10,故D正确;
故选D.
点评 本题考查原子组成和结构,难度不大,明确质量数与质子数、中子数之间的相互关系是解题的关键.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应:2Na2O2+2 H2O=4Na++4OH-+O2↑ | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2 OH-=2AlO2-+H2↑ | |
| C. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH一+H++SO42-=BaSO4↓+H2O | |
| D. | 二氧化碳通入足量氢氧化钠溶液:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO3 | B. | CaCl2 | C. | Cl2O7 | D. | Cl2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 该溶液中含硝酸钾 202 g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02 mol | |
| C. | 从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
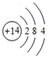 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用降温结晶的方法 | |
| B. | 除去酒精中含有的少量水采用蒸馏的方法 | |
| C. | 除去氯化钠溶液中少量的泥沙用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com