
| A. | 氯水存放在带橡胶塞的棕色广口瓶中 | |
| B. | 少量钠保存在煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 碳酸钠固体保存在广口瓶中 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
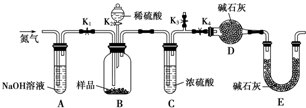
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
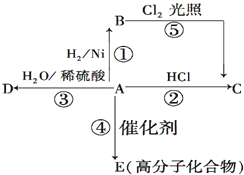 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
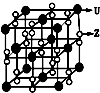 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 | |
| B. | SO2、CH2═CH2都能使溴水褪色,但原理不同 | |
| C. | NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 | |
| D. | FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CI | B. | CH2=CH-CH=CH2 | C. | CH3-CH=CH2 | D. | 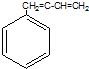 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
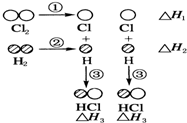 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ•mol-1 | 436 | 243 | 431 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com