
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
分析 ①溶质的质量分数为ω可由溶质的质量和溶液的质量来计算;
②根据物质的量浓度c=$\frac{n}{V}$进行计算;
③根据溶质的质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%来计算;
④反应后溶质为氯化铵,铵根离子部分水解,溶液呈酸性,c(H+)>c(OH-)、根据电荷守恒可知c(Cl-)>c(NH4+).
解答 解:①VmL氨水,溶液的密度为ρg•cm-3,溶液的质量为ρVg,溶质的质量为:$\frac{a}{22.4}$×17,则溶质的质量分数为ω=$\frac{17a}{22.4Vρ}$×100%,故①错误;
②溶质的物质的量为:$\frac{a}{22.4}$mol,溶液的体积为VmL,则c=$\frac{1000a}{22.4V}$mol/L,故②正确;
③再加入VmL水后,所得溶液的质量分数为:$\frac{ρVω}{ρV+{ρ}_{水}V}$=$\frac{1}{1+\frac{{ρ}_{水}}{ρ}}$,水的密度大于氨水的密度,则1+$\frac{{ρ}_{水}}{ρ}$>2,故所得溶液的质量分数小于0.5ω,故③错误;
④向上述溶液中加入VmL C mol•L-1的稀盐酸,充分反应后溶液中溶质为氯化铵,铵根离子部分水解,溶液呈酸性,c(H+)>c(OH-)、根据电荷守恒可知c(Cl-)>c(NH4+),溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故④正确;
故选A.
点评 本题考查物质的量浓度的有关计算,题目难度中等,明确质量分数与物质的量浓度的关系、氨水的密度与水的密度大小是解答本题的关键,试题培养了学生的分析能力及化学计算能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题

| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 用0.0100mol/L硝酸银标准溶液,滴定Cl-、Br-及I-且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 热稳定性:HCl>H2S>PH3 | B. | 原子半径:Na<Mg<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 碱性强弱:LiOH>NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
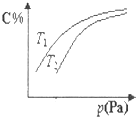 在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )
在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )| A. | 若正反应方向△H<0,则T2<T1 | |
| B. | 压强增大时,混合气体的平均相对分子质量增大 | |
| C. | A不一定为气体 | |
| D. | B一定为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个键的之间夹角为120° | B. | B-F键的键能相同 | ||
| C. | 3个B-F键的键能相同 | D. | 3个B-F键的键长相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.0×10-13 | B. | 2.0×10-12 | ||
| C. | $\frac{1}{5}$(1×10-+4×10-5) | D. | $\frac{1}{5}$(1×10-13+4×10-9) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石属于化学变化 | |
| B. | 金刚石和石墨具有相似的物理性质 | |
| C. | C60是碳元素的一种单质,其摩尔质量为720 | |
| D. | 由碳元素单质组成的物质一定是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com