
【题目】下列关于乙炔制取的说法不正确的是( )
A. 为了加快反应速率可用饱和食盐水代替水
B. 此反应是放热反应
C. 为了除去H2S杂质气体,可用氢氧化钠溶液洗气
D. 反应中不需加碎瓷片作沸石
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g) ![]() 2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是
A.v(C)=0.2 mol/(L·min)
B.z=3
C.B的转化率为25%
D.C的体积分数约为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A.A的平均反应速率是0.010mol·L-1·s-1
B.容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比—定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
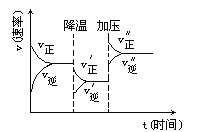
A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体
C.改变物质浓度,平衡不会移动 D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘和CCl4,其实验过程如下:
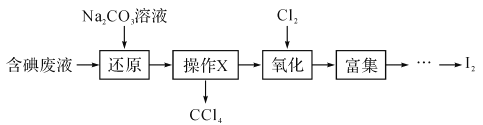
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
______________;该操作将I2还原为I-的主要目的是 ____________ 。
(2)操作X的名称为 ___。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_____________;锥形瓶里盛放的溶液为_______________

(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有 ___(化学式),②加入少量活性炭的目的是 ______ ,③操作Y的名称是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3 500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L lmol/L的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g.
(1) Cu与Cu2O的物质的量之比为___________________。
(2) HNO3的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂拟综合处理含NH4-废水和工业废气(主要含N2、CO2、.SO2、NO、CO,不考虑其它成分),设计了如下流程:
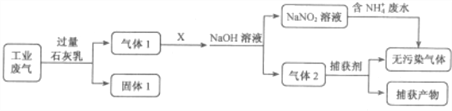
已知:NO+NO2+2NaOH=2NaNO2+H2O
回答下列问题:
(1)固体1的主要成分Ca(OH)2、CaCO3和______。
(2)气体X与气体1反应时起到的作用是______(填“氧化剂”、“还原剂”或“即不是氧化剂也不是还原剂”),捕获剂所捕获的气体主要是______ (填化学式)。
(3) NaOH溶液吸收等物质的量的NO、NO2气体过程中,当生成1molNaNO2时转移电子数为_______NA。
(4)用NaNO2溶液处理含NH4-废水时,发生反应的离子方程式为__________;含NH4-废水也可用沉淀法处理:Mg2++NH4- +PO43-=== MgNH4PO4↓, 已知25℃时,Ksp(MgNH4PO4)=2.5×10-13 。向废水中按比例投入镁盐和磷酸盐,欲使沉淀后废水中残留的铵态氮达到一级排放标准(≤1.0mg·L-1,即≤7.14×10-5 mol·L-1),且c(PO43-)=1.0×10-5 mol·L-1,则应使沉淀后的废水中c( Mg2+) ≥________。
(5)电化学氧化法是处理氨氮废水的一种新工艺。间接电氧化的原理是:向废水中加入一定量的氯离子,使其电解时在阳极放电生成氯单质,利用氯单质与水反应生成的次氯酸将NH4+氧化 为氮气。最后一步反应的离子方程式为__________________________。
(6) 已知25℃时,HNO2的电离常数Ks =5.1×10-4。实验室常用NaOH溶液吸收NO2尾气,反应为2NO2+ 2NaOH==NaNO3+ NaNO2+H2O。若用1L 0.4 mol·L-1Na(OH)溶液充分吸收0.4mol NO2气体,则所得溶液显___(填“酸性”、“碱性”或“中性”),原因是___________(用离子方程式表示);忽略溶液体积变化,近似计算所得溶液的pH≈____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com