
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.分析 A元素在地壳中的含量居第四位,则A为Fe;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,则B为Mg;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si;F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体,则F为H元素;通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分,则E为O元素,据此解答.
解答 解:A元素在地壳中的含量居第四位,则A为Fe;B原子最外层电子数是内层电子总数的$\frac{1}{5}$,原子只能有3个电子层,最外层电子数为2,则B为Mg;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si;F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体,则F为H元素;通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分,则E为O元素;
(l)A为Fe元素,其基态原子的电子排布式为1s22s22p63s23p63d64s2,则基态原子的外围电子排布式为3d64s2;因N的3d轨道为半充满结构,不易失电子,第一电离能较大,即N的第一电离比氧大,故答案为:3d64s2;>;
(2)B是Mg、C是N元素,二者形成化合物氮化镁,化学式为Mg3N2,是离子化合物;故答案为:Mg3N2;离子;
(3)①H与O可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,X为H2O、Y为H2O2,FeCl3是H2O2分解的催化剂,发生反应的化学方程式为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
②H与N组成的两种化合物M和N所含的电子数分别与H2O、H2O2相等,则M为NH3、N为N2H4,则NH3的水溶液显碱性,N2H4的结构式为 ,
,
故答案为:碱; ;
;
(4)H的原子半径是最小的,N、O和Mg、Si分属两个不同的周期,同周期核电荷数越大,原子半径越小,即B到F所有元素的原子半径大小顺序为Mg>Si>N>O>H;故答案为:Mg>Si>N>O>H;
(5)Fe有FeCl2和FeCl3两种氯化物,可利用氧化剂将FeCl2氧化为FeCl3,利用还原剂将FeCl3还原为FeCl2,发生的化学方程式为:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2,故答案为:2FeCl2+Cl2=2FeCl3、Fe+2FeCl3=3FeCl2.
点评 本题考查了位置结构性质的关系及应用,涉及氧化还原反应原理的应用、物质结构、核外电子排布等知识点,为基础考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 各物质的浓度保持不变 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:④>③>②>① | B. | 原子半径:④>③>②>① | ||
| C. | 第一电离能:④>③>②>① | D. | 最高正化合价:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1标准大气压下原子数为NA的水蒸气为1mol | |
| B. | 1L1mol/L的NaOH溶液中Na+的物质的量为1mol | |
| C. | 标准状况下,22.4L氦气的质量为4g | |
| D. | 用含1molHCl的盐酸制取氯气,氯元素失去的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| D. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
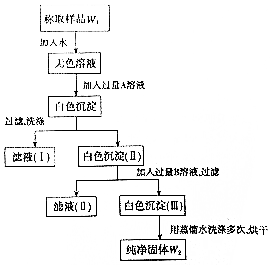 实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.
实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
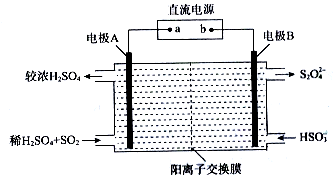
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
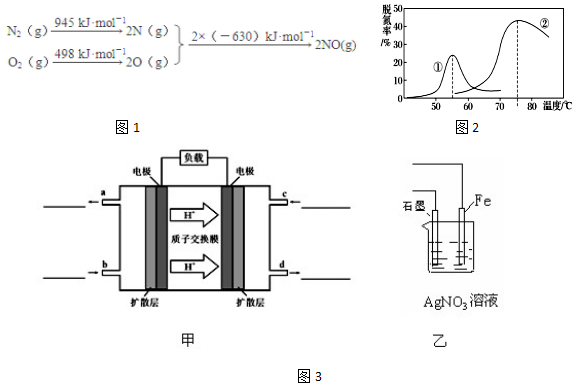
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com