
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
分析 A、依据n=$\frac{m}{M}$计算物质的量.结合重水分子中的电子数计算判断;
B、1molAl与足量的盐酸反应转移3mol电子,故0.5molAl与足量的盐酸反应转移1.5mol电子,即1.5×6.02×1023=9.03×1023电子;
C、注意气体摩尔体积使用的条件;
D、据n=CV计算出Na2SO4的物质的量,并求其中Na+数目,与0.005mol F-所含电子数相比较.
解答 解:A、常温常压下,18.0 g重水(D2O)物质的量=$\frac{18.0g}{20g/mol}$,所含的电子数=$\frac{18.0g}{20g/mol}$×10×6.02×1023,故A错误;
B、1molAl与足量的盐酸反应转移3mol电子,故0.5molAl与足量的盐酸反应转移1.5mol电子,即1.5×6.02×1023=9.03×1023电子,故B错误;
C、标况下,水为液态,故C错误;
D、n(Na2SO4)=CV=0.05L×0.5mol/L=0.025mol,则n(Na+)=0.05mol,1mol F-所含电子数为10mol,则0.005mol F-所含电子数为0.05mol,故50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F-所含电子数相同,故D正确,
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积的条件应用,质量换算物质的量计算微粒数,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL4mol/L的硫酸与足量Cu共热,转移的电子数为0.4NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为0.2NA | |
| C. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为:CO2+H2 $?_{高温}^{催化剂}$ CO+H2O | |
| B. | 恒温恒容下,增大压强,H2 浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的反应热为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| B. | H2SO4(aq)+2NaOH (aq)═Na2SO4(aq)+2H2O (l)△H=-114.6kJ/mol(中和热) | |
| C. | S (s)+O2(g)═SO2 (g)△H=-296.8kJ/mol(燃烧热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
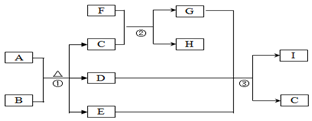 有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.
有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体. .
. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH<7 | B. | CN-的水解程度大于HCN的电离程度 | ||
| C. | c(CN-)+c(HCN)=0.02 mol•L-1 | D. | c(CN-)+c(OH-)=0.01 mol•L-1+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
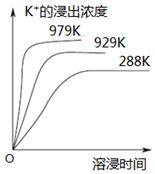 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com