
����Ŀ����ʮ��������ѧ�����߶�̼�����������˹㷺������о���ȡ����һЩ��Ҫ�ɹ����ڸ��¸�ѹ��CO���м��ߵĻ�ѧ���ԣ�������ֵ��ʻ��ﷴӦ��
��1����ҵ�ϳ�����ˮ�����絽���ȵ�̿����ʵ��ú���������Ƶ�CO��H2�����÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2������ú��������������̿�㽻�����������ˮ���������������Ŀ���� ����Ӧ���ɵ������ڼ��ȡ������������������ϳ�Һ��ȼ�ϼ״����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��һ�������£�CO��H2�ɺϳɼ��飬��Ӧ����ʽΪ��CO��g��+3H2��g��![]() CH4��g��+H2O ��g���������£��÷�Ӧ�ܹ��Է����е�ԭ���� ��
CH4��g��+H2O ��g���������£��÷�Ӧ�ܹ��Է����е�ԭ���� ��
��4��CO������ȼ�ϵ����ʹ�õĵ�����Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2�����õ�������ĵ缫��ӦʽΪ ��
��5����ҵ�Ͽ�ͨ���״��ʻ�������ȡ�����������Ӧ����ʽΪ��
CH3OH��g����CO��g��![]() HCOOCH3��g�� ��H =��29.1 kJ��mol��1
HCOOCH3��g�� ��H =��29.1 kJ��mol��1
������Ա������Ӧ�������о��������о�������£�
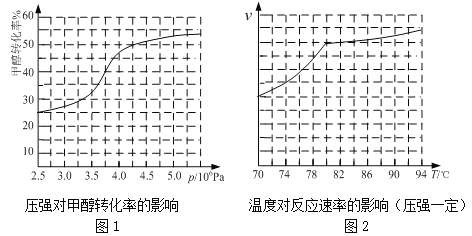
�����ݷ�Ӧ��ϵ��ѹǿ�Լ״�ת���ʵ�Ӱ�첢�ۺϿ��������ɱ����أ���ҵ��ȡ�������Ӧѡ���ѹǿΪ ��
a��3.5��106Pa b��4.0��106Pa c��5.0��106Pa
��ʵ�ʹ�ҵ�����в��õ��¶��� ���������� ��
���𰸡���1��C��H2O![]() CO��H2
CO��H2
��2���ò���̿ȼ�����ṩ̿��ˮ������Ӧ����Ҫ������ CO + 2H2![]() CH3OH
CH3OH
��3�� ��H��0
��4��O2 + 4e��=2O2��
��5����b
��80�����¶ȵ���80������Ӧ���ʽ�С���¶ȸ���80�������¶Է�Ӧ����Ӱ���С���Ҹ÷�Ӧ���ȣ������¶�ƽ�������ƶ���ת���ʽ��͡�
��������
�����������1����ҵ�ϳ�����ˮ�����絽���ȵ�̿����ʵ��ú���������Ƶ�CO��H2�����÷�Ӧ�Ļ�ѧ����ʽ�ǣ�C��H2O![]() CO��H2��
CO��H2��
�ʴ�Ϊ��C��H2O![]() CO��H2��
CO��H2��
��2�����ݣ�1��ú��ˮ�����ķ�Ӧ����һ����̼������Ҫ���ȣ������������Ŀ�����ò���̿ȼ�գ���
��̿��ˮ������Ӧ����Ҫ��������һ����̼��������һ�������ºϳɼ״���ԭ��Ϊ��CO+2H2![]() CH3OH��
CH3OH��
�ʴ�Ϊ���ò���̿ȼ�գ��ṩ̿��ˮ������Ӧ����Ҫ��������CO+2H2![]() CH3OH��
CH3OH��
��3����CO��g��+3H2��g��![]() CH4��g��+H2O��g������Ӧ��S��0�������Է����е��ж����ݡ�H-T��S��0�����ԡ�H��0��
CH4��g��+H2O��g������Ӧ��S��0�������Է����е��ж����ݡ�H-T��S��0�����ԡ�H��0��
�ʴ�Ϊ���÷�Ӧ��H��0��
��4��COһ����ȼ�ϵ�أ�һ����̼�ڸ���ʧ���ӷ���������Ӧ��������Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2���õ�ظ����ĵ缫��ӦʽΪ��CO-2e-+O2-=CO2�������缫��ӦΪ��O2 + 4e��=2O2����
�ʴ�Ϊ��O2 + 4e��=2O2����
��5���ٴӷ�Ӧѹǿ�Լ״�ת���ʵ�Ӱ�조Ч�ʡ�����ͼ����ת���ʱ仯������4.0��106Pa����b��ȷ��
�ʴ�Ϊ��b��
��ʵ�ʹ�ҵ�����в��õ��¶���80��C������ͼ������¶����¶ȵ���80������Ӧ���ʽ�С���¶ȸ���80�������¶Է�Ӧ����Ӱ���С���Ҹ÷�Ӧ���ȣ������¶�ƽ�������ƶ���ת���ʽ��͡�
�ʴ�Ϊ��80�棻�¶ȵ���80������Ӧ���ʽ�С���¶ȸ���80�������¶Է�Ӧ����Ӱ���С���Ҹ÷�Ӧ���ȣ������¶�ƽ�������ƶ���ת���ʽ��͡�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I(C12H14O3)���Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳɣ�
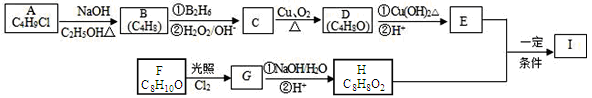
��֪������Ϣ���� A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��![]()
��������F�����ϵ�һ�ȴ���ֻ����������Fe3+����ɫ��
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
��ش��������⣺
��1��A�Ľṹ��ʽΪ ��B���������ŵ�������
��2��C������Ϊ ��E�ķ���ʽΪ ��
��3��A��B��C��D�ķ�Ӧ���ͷֱ�Ϊ �� ��
��4��д��G��H�з�Ӧ���Ļ�ѧ����ʽ ��
��5��I�Ľṹ��ʽΪ ��
��6��I��ͬϵ��J��I����Է�������С28��J��ͬ���칹������ͬʱ����������������������ֻ������ȡ�����������ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������ ��(�����������칹)��J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2��2��1��д��J������ͬ���칹��Ľṹ��ʽ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������G��![]() ����һ�����ϣ�һ�ֺϳ�·�����£�
����һ�����ϣ�һ�ֺϳ�·�����£�

��֪������Ϣ��
��![]() ��
��
��CΪ��ȩ��ͬϵ���ͬ���������������������ܶȱ�Ϊ22���ش��������⣺
��1��A�Ļ�ѧ����Ϊ ��
��2��B��C��Ӧ����D�Ļ�ѧ����ʽΪ ��
��3��F�к��й����ŵ�����Ϊ ��
��4��E��F��Ӧ����G�Ļ�ѧ����ʽΪ ��
��Ӧ����Ϊ ��
��5��F��ͬ���칹���в���������Ʒ�Ӧ���������Ĺ��� �֣������������칹�������к˴Ź�������ֻ������壬�ҷ������Ϊ3:1��Ϊ ��д�ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ��Zn��Cu�ܺ���ԼΪ99%������ͭ���Ʊ�ZnO�IJ���ʵ�����������
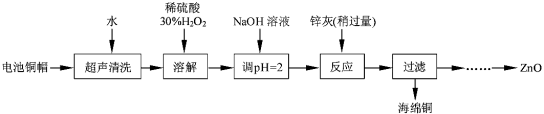
��1����д��ͭñ�ܽ������з�����Ӧ�Ļ�ѧ����ʽ ��
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽���� ��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�
2Cu2����4I��=2CuI����ɫ������I2 I2��2![]() =2I����
=2I����![]()
���ζ�ѡ�õ�ָʾ��Ϊ ���ζ��յ�۲쵽������Ϊ ��
�����ζ�ǰ��Һ��H2O2û�г�������������Cu2���ĺ������� ���ƫ�ߡ�����ƫ�͡��������䡱����
��3����֪pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�����±��г����������������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol��L��1������
Fe3�� | Fe2�� | Zn2�� | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
��ȫ������pH | 3.2 | 8.8 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
������ͭ������Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
�� ��
�� ��
�� ���ˣ�
�� ��
�� ���ˡ�ϴ�ӡ�����
�� 900�����ա�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС������ͼ��ʾװ����֤±�ص��������Ե����ǿ��������˵������ȷ����( )
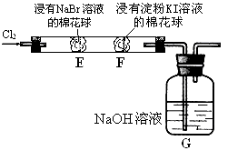
A��E�������ɻ�ɫ��˵��Cl2�������Ա�Br2ǿ
B��F����������ɫ��˵��Br2�������Ա�I2ǿ
C��E��������Ӧ�����ӷ���ʽΪ��Cl2+ 2Br����2Cl��+ Br2
D��Gװ����NaOH��Һ��Cl2��Ӧ�����ӷ���ʽΪ��2OH�� + Cl2 = ClO��+ Cl��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ؾ�λ�ڵ���A�壬���зǽ�������ǿ��Ԫ���ǣ���
A. F B. Cl C. Br D. I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������Һ���ܴ�������������ǣ� ��
A��S2�� B��AlO2�� C��HCO3�� D��NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��������ʱ��ֻ������ˮ���ռ����ǣ� ��
A. CH4 B. CO2 C. NO D. NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йطǽ������仯�����˵����ȷ���ǣ� ��
A. �����ʹ��ɫʯ����Һ���ɫ
B. ��������ͨ����ɫʯ����Һ�У���Һ�ȱ�����ɫ
C. ����п����ϡ���ᷴӦ�Ʊ�����
D. Һ���ӷ������Դ��Һ����Լ�ƿ��Ӧ��ˮ�Ᵽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com