
| A、Fe2(SO4)3 |
| B、ZnSO4 |
| C、KNO3 |
| D、NaCl |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p63s23p63d74s2 |
| B、1s22s22p63s23p63d54s1 |
| C、1s22s22p63s23p63d104s24p1 |
| D、1s22s22p63s23p64s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
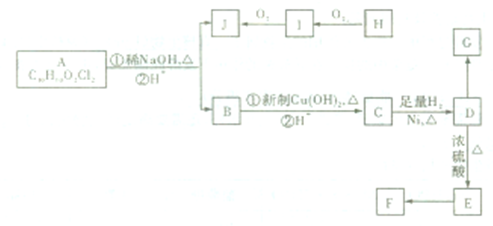
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3.2 | 6.0 | 6.5 | 7 |
| CO | C-O | C=O | C≡O | ||
键能(kJ?mol
| 357.7 | 798.9 | 1071.9 | ||
| N2 | N-N | N=N | N≡N | ||
键能(kJ?mol
| 154.8 | 418.4 | 941.7 |
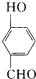 比
比 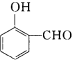 的沸点
的沸点查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置进行乙酸乙酯水解 |
| B、用图2所示装置实验室制取乙烯 |
| C、碘水用CCl4萃取分液后再蒸馏,可得到I2 |
| D、梨形分液漏斗检漏,加水后玻璃旋塞处是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
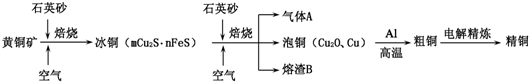
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
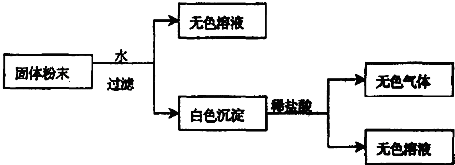
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com