
| A. | 单质的沸点:a>d>c | |
| B. | 简单离子的半径:c>d>a>b | |
| C. | a、b、c简单离子都会破坏水的电离平衡 | |
| D. | a、b、d的最高价氧化物对应的水化合物两两皆能反应 |
分析 a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.b、c原子的次外层电子数均为8,则b为Al、c为S,a、d的简单离子的电子层结构相同,则a为Na、d为F.
A.根据常温下物质的状态判断;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
C.a、b、c简单离子分别为Na+、Al3+、S2-,Na+不水解,不破坏水的电离平衡;
D.氟元素没有最高价氧化物对应的水化物.
解答 解:a、b、c、d均为短周期元素,它们原子的最外层电子数分别为1、3、6、7.b、c原子的次外层电子数均为8,则b为Al、c为S,a、d的简单离子的电子层结构相同,则a为Na、d为F.
A.Na、S为固体,而氟气为气体,故氟气沸点最低,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径c(S2-)>d(F-)>a(Na+)>b(Al3+),故B正确;
C.a、b、c简单离子分别为Na+、Al3+、S2-,Al3+、S2-均水解,破坏水的电离平衡,但Na+不水解,不破坏水的电离平衡,故C错误;
D.氟元素没有最高价氧化物对应的水化物,故D错误.
故选:B.
点评 本题考查结构性质位置关系应用,关键是根据核外电子排布推断与水,熟练掌握元素化合物性质.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 烷烃分子中,所有的化学键都是单键 | |
| B. | 烷烃在光照条件下都能与氯气发生取代反应 | |
| C. | 烷烃的分子通式为CnH2n+2,符合通式的烃不一定是烷烃 | |
| D. | 随着碳原子数的增加,烷烃的熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 | |
| B. | 沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 | |
| C. | SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 | |
| D. | SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
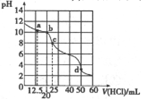 室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )
室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )| A. | a点:c(A2-)=c(HA-) | B. | b点:5c(Cl-)=4[c(A2-)+c(HA-)+c(H2A)] | ||
| C. | c点:c(Na+)>c(HA-)>c(A2-)>c(H2A) | D. | d点:c(H+)=c(HA-)+c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内运动 | |
| B. | 凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 氯化氢属于共价化合物,溶于水能电离出H+、Cl- | |
| D. | 阴、阳离子通过静电引力而形成的化学键叫离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:HF>HCl>HBr>HI | |
| B. | 稳定性:HF<HCl<HBr<HI | |
| C. | 从F2到I2,颜色逐渐加深 | |
| D. | 与氢气化合由易到难:I2>Br2>Cl2>F2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com