
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为__________反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是______________(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃ 时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2
和xmolH2,则:
当x=5.0时,上述平衡向____________(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
② 若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b% ,则a _________ b (填“>”、“<”或“=”)。
【答案】(1)吸热;(2)BC;(3)逆反应;0≤x<3.0;<
【解析】
试题分析:(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,温度升高平衡向吸热反应移动,故该反应正反应是吸热反应;
(2)A.该可逆反应反应前后气体的物质的量不变,容器内压强自始至终不变,容器中压强变,不能说明反应到达平衡,A错误;B.随反应进行CO的浓度增大,混合气体中 c(CO)不变,说明反应到达平衡,B正确;C.υ正(H2)=υ逆(H2O),不同物质表示的正逆反应速率之比等于化学计量数之比,说明反应到达平衡,C正确;D.c(CO2)=c(CO)时可能处于平衡状态,可能不处于平衡状态,与反应的条件有关,即与二氧化碳的转化率有关,D错误;答案选BC;
(3)①反应前后体积不变,可以用物质的量表示浓度计算平衡常数,此时的浓度商Qc=(1×5)/(1×3)
=1.67,大于平衡常数1,故平衡向逆反应方向移动;
②平衡向正反应方向移动,浓度商小于平衡常数,即(1×x)/(1×3)<1,解得x<3.0,所以0≤x<3:
(4)加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。

分别取它们的水溶液进行实验,结果如下:
①C,E溶液显碱性,A,B,D溶液呈酸性,0.1mol/L的E溶液PH<13;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④将38.4 g Cu片投入装有足量D溶液的试管中,Cu不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断C、D的化学式为:C______________;D_______________。
(2)写出步骤②中发生反应的离子反应方程式____________________________。
(3)步骤④中若要将Cu片完全溶解,至少加入稀H2SO4的体积是____________mL。
(4)不能确定的溶液为B和______________(填字母编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.43 g Na2CO3·xH2O溶于水配成10 mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0 mL,并收集到112 mL CO2(标准状况)。试计算:
⑴ CO2的物质的量
⑵ Na2CO3·xH2O的物质的量。
⑶ x的值。
⑷所用稀盐酸的物质的浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种钠盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A. HX、HZ、HY B. HZ、HY、HX
C. HX、HY、HZ D. HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.2g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.3.5mol·L-1 B.4.5mol·L -1 C.7.0mol·L -1 D.9.0mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧燃料电池具有很大的发展潜力,其工作原理如图所示。下列有关该电池的说法错误的是

A.该电池工作时,溶液的pH不变
B.a电极为负极,b电极为正极
C.电子从a电极流出,经过导线到达b电极
D.电池总反应为4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。

请回答下列问题:
(1)B的结构简式为 。
(2)乙烯与水反应生成A的反应类型为 。
(3)A与C反应生成乙酸乙酯的化学方程式为 ,其反应类型为 。
(4)实验室可用右图装置制取乙酸乙酯。
①在试管a中加好相关试剂后,还需要加入2—3块的碎瓷片,其作用是 。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的 (填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是 。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。
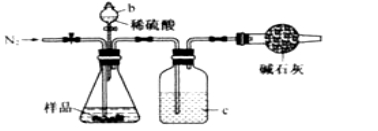
(1)甲同学用上图所示装置测定CO2的质量。实验时稀硫酸是与样品中的_________(填“Na2CO3”或
"NaCl”)发生反应。仪器b的名称是_____________。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________。
(2)乙同学用下图所示方法和步骤实验:

①操作I涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、___________。
②乙测得的样品中Na2CO3质量分数的计算式为___________________。
(3)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com