
| 1 |
| 2 |
| 3 |
| 2 |
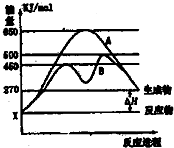
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
| 1 |
| 2 |
| 3 |
| 2 |
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
| 10-14 |
| 10-8 |
| 10-14 |
| 0.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
| �ܽ��/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�߶��ڶ����¿���ѧ�Ծ� ���ͣ������
��8�֣���1�����Ƶ�CuCl2��2H2O�����г�����Fe3+��Fe2+���ʡ����ᴿʱ�����ȼ�����ʵ�����������Fe2+����ΪFe3+�����п�ѡ�õ���������___________��
A.KMnO4 �� B.H2O2 ���� C.Cl2ˮ ���� D.HNO3
(2)��֪��������Ksp��Fe(OH)3��=8.0��10-38,Ksp��Cu(OH)2��=2.2��10-20���S2=0.3��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5mol��L-1ʱ����Ϊ������ȫ���Լ���
�ٽ���Һ��pH����PH=__________ʱFe3+ת��ΪFe(OH)3��������ȫ��
����CuSO4��Һ��Ũ��Ϊ2.2mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ__________��
(3)������Һ��pH��ѡ�������е�____________��
A.NaOH(aq) B.NH3��H2O C.CuO��ĩ D.Cu(OH)2����Һ E.Cu2(OH)2CO3(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��(Ti)����Ϊ��������֮��ĵ����������Ѱ�(TiO2)��Ŀǰ��õİ�ɫ���ϡ��Ʊ�TiO2��Ti��ԭ�����������ҹ�������������������λ������Fe2O3����������Ҫ�ɷ�ΪFeTiO3����ȡTiO2���������£�
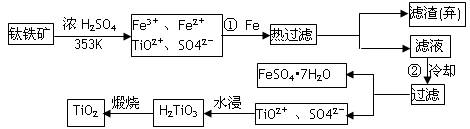
(1)Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�__________���ڣ��� �塣
(2)����ټ�Fe��Ŀ����__________________________________________________��
�������ȴ��Ŀ����__________________________________________________��
(3)�����Ʊ�TiO2�Ĺ����У��������õĸ������� �����dzɱ��ͷ����ۺ��������أ���Һ��Ӧ���� ������
(4)�ɽ��ʯ(TiO2)��ȡ����Ti���漰���IJ���Ϊ��![]()
��֪����C (s)��O2 (g)��CO2 (g)����H����393.5 kJ��mol-1
��2CO (g)��O2 (g)��2CO2 (g)����H����566 kJ��mol-1
��TiO2(s)��2Cl2 (g)��TiCl4(s)��O2(g)����H����141 kJ��mol-1
��TiO2(s)��2Cl2(g)��2C(s)��TiCl4(s)��2CO (g)�ġ�H�� ��
��ӦTiCl4��2Mg��2MgCl2��Ti��Ar�����н��е�������
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com