下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
【答案】
分析:A.纯水中c(H
+)=c(OH
-),溶液呈中性;
B.醋酸为弱酸,加水稀释促进电离;
C.根据c(H
+)=
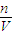
,PH=-lg[c(H
+)]计算;
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H
+)=c(OH
-)=1×10
-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大.
解答:解:A.水的电离为吸热过程,温度升高,促进电离,溶液中c(H
+)增大,PH减小,但存在c(H
+)=c(OH
-),溶液呈中性,故A错误;
B.醋酸为弱酸,加水稀释促进电离,pH=3的醋酸溶液,稀释至10倍后pH<4,故B错误;
C.0.2mol/L的盐酸,与等体积水混合后,c(H
+)=0.1mol/L,pH=1,故C正确;
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H
+)=c(OH
-)=1×10
-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大,与pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液pH<7,故D错误.
故选C.
点评:本题考查酸碱混合的计算与判断以及弱电解质问题,题目难度中等,本题注意把握弱电解质电离的特点,易错点为A,注意纯水中c(H
+)=c(OH
-).

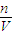 ,PH=-lg[c(H+)]计算;
,PH=-lg[c(H+)]计算;
