
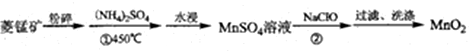
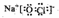 £®
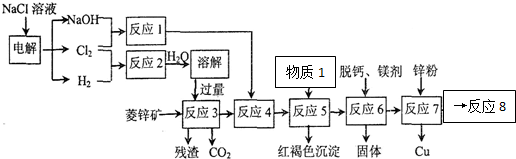
£®·ÖĪö ĮāĢśæó·ŪĖéŗó¼ÓČėĮņĖįļ§£¬²¢¼ÓČČÖĮ450”ę£¬Č»ŗóĖ®½žµĆµ½MnSO4ČÜŅŗ£¬ŌŚMnSO4ČÜŅŗÖŠ¼ÓČėNaClO·¢ÉśŃõ»Æ»¹Ō·“Ó¦æÉÉś³ÉMnO2£¬
£Ø1£©ĢįøßĖ®½žµÄŠ§ĀŹ£¬æÉÉżøßĪĀ¶Č”¢³ä·Ö½Į°čŅŌŌö“ó½Ó“„Ć껿£¬ŹµŃéŹŅĄļĻ“µÓMnO2Ź±æÉÓĆÉÕ±”¢Ā©¶·”¢²£Į§°ōµČŅĒĘ÷£»
£Ø2£©MnCO3ŗĶĮņĖįļ§·¢Éś·“Ӧɜ³ÉĮņĖįĆĢ”¢°±ĘųŗĶ¶žŃõ»ÆĢ¼£»
£Ø3£©·“Ó¦¢ŚÉś³ÉMnO2µÄĶ¬Ź±£¬µĆµ½Ņ»ÖÖ»ĘĀĢÉ«µÄĘųĢ壬ĖµĆ÷Éś³ÉĀČĘų£¬øĆ·“Ó¦ĪŖŃõ»Æ»¹Ō·“Ó¦£»
£Ø4£©n£ØMnO2£©=$\frac{87g}{87g/mol}$=1mol£¬½įŗĻMn2++2ClO-=MnO2”ż+Cl2”üŗĶCl2+2NaOH=NaCl+NaCl+H2OæɼĘĖć£»
£Ø5£©Ķعżµē½āMnSO4ŗĶH2SO4µÄ»ģŗĻŅŗÖʱøMnO2£¬ŌņMnŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬±»Ńõ»Æ£¬Ó¦ĪŖŃō¼«·“Ó¦£®
½ā“š ½ā£ŗĮāĢśæó·ŪĖéŗó¼ÓČėĮņĖįļ§£¬²¢¼ÓČČÖĮ450”ę£¬Č»ŗóĖ®½žµĆµ½MnSO4ČÜŅŗ£¬ŌŚMnSO4ČÜŅŗÖŠ¼ÓČėNaClO·¢ÉśŃõ»Æ»¹Ō·“Ó¦æÉÉś³ÉMnO2£¬
£Ø1£©ĢįøßĖ®½žµÄŠ§ĀŹ£¬æÉÉżøßĪĀ¶Č”¢³ä·Ö½Į°čŅŌŌö“ó½Ó“„Ć껿£¬ŹµŃéŹŅĄļĻ“µÓMnO2Ź±æÉÓĆÉÕ±”¢Ā©¶·”¢²£Į§°ōµČŅĒĘ÷£¬NaClOĪŖĄė×Ó»ÆŗĻĪļ£¬µē×ÓŹ½ĪŖ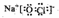 £¬
£¬
¹Ź“š°øĪŖ£ŗ¼ÓČČ£»½Į°č£»ÉÕ±”¢Ā©¶·”¢²£Į§°ō£»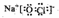 £»
£»
£Ø2£©MnCO3ŗĶĮņĖįļ§·¢Éś·“Ӧɜ³ÉĮņĖįĆĢ”¢°±ĘųŗĶ¶žŃõ»ÆĢ¼£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ£ØNH4£©2SO4+MnCO3=MnSO4+2NH3”ü+CO2”ü+H2O£¬ĄūÓĆļ§øłĄė×ÓĖ®½ā³ŹĖįŠŌµÄĢŲµć½ųŠŠ·“Ó¦£¬
¹Ź“š°øĪŖ£ŗ£ØNH4£©2SO4+MnCO3=MnSO4+2NH3”ü+CO2”ü+H2O£»
£Ø3£©·“Ó¦¢ŚÉś³ÉMnO2µÄĶ¬Ź±£¬µĆµ½Ņ»ÖÖ»ĘĀĢÉ«µÄĘųĢ壬ĖµĆ÷Éś³ÉĀČĘų£¬øĆ·“Ó¦ĪŖŃõ»Æ»¹Ō·“Ó¦£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖMn2++2ClO-=MnO2”ż+Cl2”ü£¬
¹Ź“š°øĪŖ£ŗMn2++2ClO-=MnO2”ż+Cl2”ü£»
£Ø4£©n£ØMnO2£©=$\frac{87g}{87g/mol}$=1mol£¬ÓÉMn2++2ClO-=MnO2”ż+Cl2”üæÉÖŖÉś³É1molĀČĘų£¬ŠčŅŖ2molNaCl£¬ÓÉCl2+2NaOH=NaCl+NaCl+H2OæÉÖŖ1molNaClO£¬Ōņ»¹ŠčŅŖ1molNaClO£¬
¹Ź“š°øĪŖ£ŗ1£»
£Ø5£©Ķعżµē½āMnSO4ŗĶH2SO4µÄ»ģŗĻŅŗÖʱøMnO2£¬ŌņMnŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬±»Ńõ»Æ£¬Ó¦ĪŖŃō¼«·“Ó¦£¬µē¼«·½³ĢŹ½ĪŖMn2++2H2O-2e-=MnO2+4H+£¬
¹Ź“š°øĪŖ£ŗMn2++2H2O-2e-=MnO2+4H+£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹÖʱøŹµŃé·½°øµÄÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĮ÷³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦¼°»ģŗĻĪļ·ÖĄė·½·ØĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÄÜĮ¦¼°ĶʶĻÄÜĮ¦µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Īų»ÆĒā£ØH2Se£©ŹĒÓŠÉ«”¢ÓŠ¶¾µÄĘųĢ壬±ČH2SĪČ¶Ø | |
| B£® | ķĮ£ØAt£©ĪŖÓŠÉ«¹ĢĢ壬AgAtÄŃČÜÓŚĖ®Ņ²²»ČÜÓŚĻ”ĻõĖį | |
| C£® | ŌŚŃõĘųÖŠ£¬ļØ£ØRb£©µÄČ¼ÉÕ²śĪļ±ČÄʵÄČ¼ÉÕ²śĪļøüø“ŌÓ | |
| D£® | ĮņĖįļČ£ØSrSO4£©ŹĒÄŃČÜÓŚĖ®µÄ°×É«¹ĢĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ņ»øöĢ¼ÉĻĮ¬ÓŠĮ½øöĢž»ł²»Ņž¶Ø£¬ČŻŅ׏§Č„Ņ»·ŻĖ®£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
Ņ»øöĢ¼ÉĻĮ¬ÓŠĮ½øöĢž»ł²»Ņž¶Ø£¬ČŻŅ׏§Č„Ņ»·ŻĖ®£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ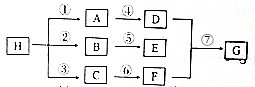

 +2NaOH$”ś_{”÷}^{Ė®}$
+2NaOH$”ś_{”÷}^{Ė®}$ +2NaCl+2H2O
+2NaCl+2H2O £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆŗĻ³É¹ż³ĢŹĒ»Æѧ±ä»Æ | B£® | øĆŌŖĖŲŌŚµŚĘßÖÜĘŚ¢õ¢ņA×å | ||
| C£® | øĆŌŖĖŲŹĒ·Ē½šŹōŠŌ±Č½ĻĒæµÄŌŖĖŲ | D£® | øĆŌŖĖŲŠĪ³ÉµÄĒā»ÆĪļ±Č½ĻĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
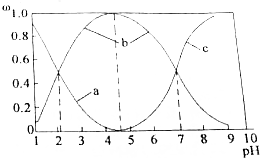
| Ąė×Ó | æŖŹ¼³ĮµķŹ±µÄPH | ĶźČ«³ĮµķŹ±µÄPH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
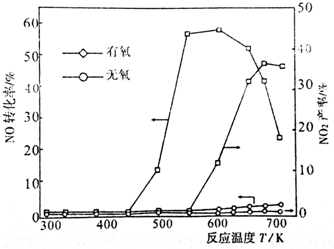
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ĀČ»ÆŃĒķæ£ØSOCl2£©ŅŗĢåŹĒŅ»ÖÖÖŲŅŖµÄÓŠ»śŗĻ³ÉŹŌ¼Į£¬»¹ÓĆÓŚÅ©Ņ©”¢Ņ½Ņ©”¢Č¼ĮĻµÄÉś²śµČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
ĀČ»ÆŃĒķæ£ØSOCl2£©ŅŗĢåŹĒŅ»ÖÖÖŲŅŖµÄÓŠ»śŗĻ³ÉŹŌ¼Į£¬»¹ÓĆÓŚÅ©Ņ©”¢Ņ½Ņ©”¢Č¼ĮĻµÄÉś²śµČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠĀÖĘĀČĖ®³Źµ»ĘĀĢÉ«£ØHCl£© | |
| B£® | ŠĀÖĘĀČĖ®ÖŠµĪ¼ÓAgNO3ČÜŅŗÉś³É°×É«³Įµķ£ØCl-£© | |
| C£® | ĻņNaHCO3ČÜŅŗÖŠ¼ÓČėŠĀÖĘĀČĖ®£¬ÓŠĪŽÉ«ĘųÅŻ£ØH+£© | |
| D£® | ½«ÓŠÉ«²¼Ģõ·ÅČėŠĀÖĘĀČĖ®ÖŠ£¬ÓŠÉ«²¼ĢõĶŹÉ«£ØHClO£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ijĶ¬Ń§æ“µ½”°ĄūÓĆĮć¼ŪĢś»¹ŌNO3-ĶŃ³żµŲĻĀĖ®ÖŠĻõĖįŃĪ”±µÄĻą¹Ų׏ĮĻŗó£¬ĄūÓĆČēĻĀ×°ÖĆĢ½¾æĢś·ŪÓėKNO3ČÜŅŗµÄ·“Ó¦£®ŹµŃé¹ż³ĢČēĻĀ£ŗ
ijĶ¬Ń§æ“µ½”°ĄūÓĆĮć¼ŪĢś»¹ŌNO3-ĶŃ³żµŲĻĀĖ®ÖŠĻõĖįŃĪ”±µÄĻą¹Ų׏ĮĻŗó£¬ĄūÓĆČēĻĀ×°ÖĆĢ½¾æĢś·ŪÓėKNO3ČÜŅŗµÄ·“Ó¦£®ŹµŃé¹ż³ĢČēĻĀ£ŗ| ¼ŁÉč | ŹµŃé²Ł×÷ | ĻÖĻó¼°½įĀŪ |
| ¼ŁÉč1£ŗĢ¼·ŪæÉÓĆ×÷»¹Ō¼Į£¬ĶŃ³żĻõĖįŃĪ | ĻņÉÕ±ÖŠ¼ÓČė Ģ¼·ŪŅ»¶ĪŹ±¼äŗ󣬲ā¶ØÉÕ±ÖŠNO3-µÄÅØ¶Č | NO3-ÅضČĪŽĆ÷ĻŌ±ä»Æ£¬ĖµĆ÷¼ŁÉč²»³ÉĮ¢ |
| ¼ŁÉč2£ŗĢ¼·Ū”¢Ģś·ŪŠĪ³ÉĪŽŹżøöĪ¢Š”µÄŌµē³Ų£¬“Ł½ųĮĖĻõĖįŃĪµÄĶŃ³ż | °“ĻĀĶ¼ĖłŹ¾×é×°ŹµŃé×°ÖĆ£¬Ņ»¶ĪŹ±¼äŗ󣬲ā¶ØNO3-ÅضČ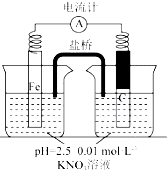 | Feµē¼«²æ·ÖČܽā£¬µēĮ÷¼ĘÖøÕėĘ«×Ŗ£¬ĖµĆ÷¼ŁÉč2³ÉĮ¢ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com