
���� ��1����Ӧǰ������������С���ر��С����Ӧ�Է����е��ж��ǡ�H-T��S��0��
��2����һ���¶��£���2L���ܱ������м���2mol N2 ��2mol H2������3H2��g��+N2��g��?2NH3��g����H=-92.2KJ/mol����Ӧ���е�5minʱ�ﵽƽ�⣬���������NH3���ʵ���Ϊ1.2mol����ϻ�ѧƽ�����м�����ʽ����ƽ�ⳣ����
3H2��g��+N2��g��?2NH3��g��
��ʼ����mol/L�� 1 1 0
�仯����mol/L�� 0.9 0.3 0.6
ƽ������mol/L�� 0.1 0.7 0.6
��ƽ�����ԭ�¶Ȳ��䣬�����������ѹ����1L�������ʱŨ����Qc��ƽ�ⳣ���Ƚ��ж�ƽ����еķ��������´ﵽƽ�⣬ƽ�ⳣ�����䣬�ݴ˼����ʱ��ƽ����ϵ��N2�����������
��3������ߵ�λʱ�䰱����������Ҫ�ӿ췴Ӧ���ʡ���ѧƽ��������У�
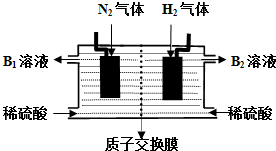
��4����N2ͨ��һ������H2ͨ����һ�����缫���Ƕ��Բ��ϣ����������ϡ���ᣬ���Ͻ��з�Ӧ���Ϳ��Եõ���Σ�
����������ԭ��Ӧ��֪��ͨ�뵪����һ��Ϊ�����õ����ӷ�����ԭ��Ӧ����������Һ������笠����ӣ�ͨ��������һ��Ϊ����ʧ���ӷ���������Ӧ��������Һ�����������ӣ�B1Ϊ�������Һ��笠������ش�����������ӣ�笠�����ˮ����Һ�����ԣ�
��� �⣺��1��3H2��g��+N2��g��?2NH3��g����H=-92.2KJ/mol����Ӧ�����������С�ķ��ȷ�Ӧ���ر��С���˷�Ӧ��һ���ؼ��ķ�Ӧ����H��0����S��0�������H-T��S��0����Ҫ�ڵ����·�Ӧ�Է����У�
�ʴ�Ϊ���ؼ����ϵͣ�
��2����һ���¶��£���2L���ܱ������м���2mol N2 ��2mol H2������3H2��g��+N2��g��?2NH3��g����H=-92.2KJ/mol����Ӧ���е�5minʱ�ﵽƽ�⣬���������NH3���ʵ���Ϊ1.2mol����ϻ�ѧƽ�����м�����ʽ����ƽ�ⳣ����
3H2��g��+N2��g��?2NH3��g��
��ʼ����mol/L�� 1 1 0
�仯����mol/L�� 0.9 0.3 0.6
ƽ������mol/L�� 0.1 0.7 0.6
K=$\frac{0��{6}^{2}}{0��{1}^{3}��0.7}$=514.3
��ƽ�����ԭ�¶Ȳ��䣬�����������ѹ����1L��Qc=$\frac{1��{2}^{2}}{0��{2}^{3}��1.4}$=128.57��K����Ӧ������У�
3H2��g��+N2��g��?2NH3��g��
��ʼ����mol/L�� 0.2 1.4 1.2
�仯����mol/L�� 3x x 2x
ƽ������mol/L�� 0.2-3x 1.4-x 1.2+2x
x=0.8
��ʱ��ƽ����ϵ��N2���������=$\frac{1.4-0.8}{0.2-3��0.8+1.4-0.8+1.2+2��0.8}$��100%=50%��
�ʴ�Ϊ��514.3��50%��
��3���ںϳɰ���ҵ����ʱ�����д�ʩ������ߵ�λʱ�䰱����������Ҫ��߷�Ӧ���ʡ�ƽ��������еȣ�
A���ӷ�Ӧ������в��Ϸ������������ƽ��������У���λʱ�䰱����������A��ȷ��
B����һ���ķ�Χ�ڣ�����Ӧ��ϵ��ѹǿ��ƽ��������У�������λʱ��������ӣ���B��ȷ��
C��ʹ������ý�����ӿ췴Ӧ���ʣ����ӵ�λʱ���ڰ���������������C��ȷ��
D�����ӷ�Ӧ���������ƽ��������У���Ӧ���ʼӿ죬����λʱ���ڰ����IJ�������D��ȷ��
�ʴ�Ϊ��ABCD��
��4���ٰ�N2ͨ��һ������H2ͨ����һ�����缫���Ƕ��Բ��ϣ����������ϡ���ᣬ���Ͻ��з�Ӧ���Ϳ��Եõ���Σ�����������ԭ��Ӧ��֪��ͨ�뵪����һ��Ϊ�����õ����ӷ�����ԭ��Ӧ����������Һ������笠����ӣ��缫��ӦΪ��N2+8H++6e-=2 NH4+��ͨ��������һ��Ϊ����ʧ���ӷ���������Ӧ��������Һ�����������ӣ�
�ʴ�Ϊ������N2+8H++6e-=2 NH4+��
��B1Ϊ�������Һ��笠������ش�����������ӣ�笠�����ˮ����Һ�����ԣ���Һ������Ũ�ȴ�С��˳����c��NH4+����c��SO42-����c��H+����c��OH-����
�ʴ�Ϊ��c��NH4+����c��SO42-����c��H+����c��OH-����
���� ���⿼���˷�Ӧ�������е��ж����ݡ���ѧƽ�ⳣ���ļ��������Ӱ�췴Ӧ���ʺ�ƽ������ء�ԭ���ԭ���͵缫��Ӧ��д���������Һ������Ũ�ȴ�С�Ƚϵ�֪ʶ�㣬���վ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ��Һ | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{n��A-N-2��}{A}$ mol | B�� | $\frac{n��A-N+8��}{A+16}$mol | C�� | $\frac{n��A-N+8��}{A+8}$mol | D�� | $\frac{n��A-N+2��}{A}$mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ��AgBr�������� | B�� | AgCl��������AgBr���� | ||
| C�� | AgCl��������AgBr���� | D�� | AgCl��AgBr������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
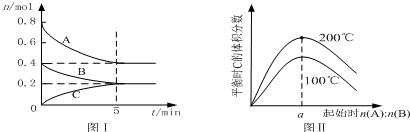
| A�� | 200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v��B��=0.04 mol•L-1•min-1 | |
| B�� | ͼ����֪��ӦxA��g��+yB��g��?zC��g���ġ�H��0����a=2 | |
| C�� | ����ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�����´ﵽƽ��ǰv��������v���棩 | |
| D�� | 200��ʱ���������г���2 mol A ��1 mol B���ﵽƽ��ʱ��A ���������С��0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| 700�� | 900�� | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
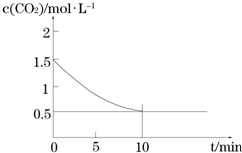
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼�������Һ�������������Ʋ����ȣ�NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$H2O+NH3�� | |
| B�� | Na218O2����H2O��2Na218O2+2H2O�T4Na++4OH-+18O2�� | |
| C�� | ����þ��Һ�Ӱ�ˮ��Mg2++2NH3•H2O�TMg��OH��2��+2NH4+ | |
| D�� | ������������ϡ���FeO+2H+�TFe2++H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4 | B�� | CH2 CH2 | C�� | CH2--CH2 | D�� | CH2=CH2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com