
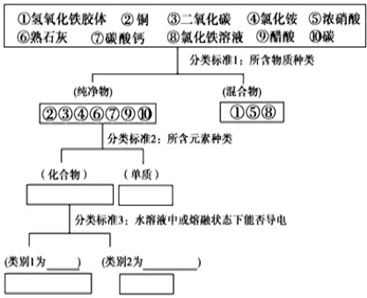
分析 在水溶液或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下均不导电的化合物是非电解质;在水溶液中完全电离成离子的电解质属于强电解质,发生部分电离的电解质属于弱电解质,据此分析.
解答 解:在水溶液或熔融状态下能导电的化合物是电解质,如④、⑥、⑦、⑨,在水溶液中完全电离成离子的电解质属于强电解质,如④、⑥、⑦;在溶液中发生部分电离的电解质属于弱电解质如⑨;③二氧化碳与水反应生成碳酸,碳酸在溶液中发生两步电离,以第一步为主,碳酸的电离方程式为:H2CO3?H++HCO3-,
故答案为:④、⑥、⑦;⑨;H2CO3?H++HCO3-.
点评 本题考查了物质的量分类、电解质和非电解质、强电解质和弱电解质等,题目难度不大,侧重于基本概念的考查,考查了学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 标准状况下,32gSO2的体积约为22.4L | |
| D. | 物质的量浓度为1mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | Ⅰ | Ⅱ |
| A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
| B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
| C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
| D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
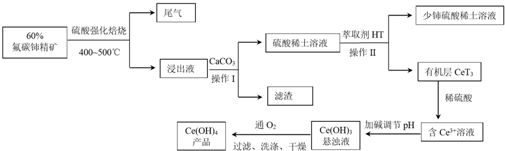
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
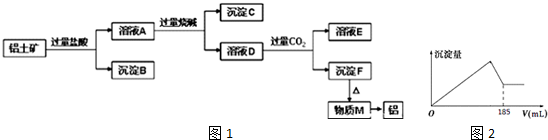
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果容器内压强不再改变,则证明该反应已达到平衡状态 | |
| B. | 寻找合适的催化剂是加快反应速率并提高CO2产率的有效措施 | |
| C. | 当反应达到平衡后,保持容器内体积不变,再向其中充入CO和H2O(g)各1 mol,达到新的平衡后CO2的产率会增大 | |
| D. | 如果在某温度下平衡常数为9.0,则平衡时CO转化率为75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com