
| A. | 原子序数是34 | B. | 最高价氧化物的化学式为SeO3 | ||
| C. | 金属性比较强 | D. | 气态氢化物的化学式为H2Se |
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2 | B. | Br2、Cl2、I2 | C. | I2、Cl2、Br2 | D. | I2、Br2、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
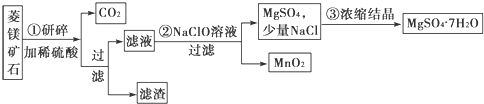
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
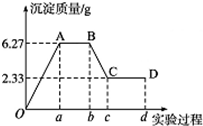 下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:
下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.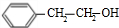 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2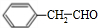 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2作氧化剂 | B. | 铜元素化合价升高 | ||
| C. | 氢元素化合价降低 | D. | Cu是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com