
 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.分析 (1)①2H2(g)+O2 (g)=2H2O (l)△H=-283.0kJ•mol-1 ①
2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-726.0kJ•mol-1 ②
依据盖斯定律①×3-②得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)依据盖斯定律计算焓变,进而书写热化学方程式;
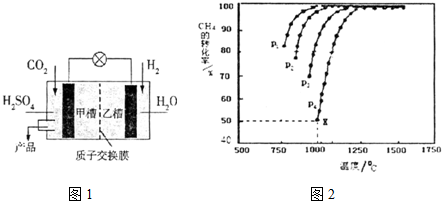
②根据图2,甲槽为CO2得电子发生还原反应生成CH3OH,据此书写反应式;
(2)①可逆反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答;
③反应在图象中X点的甲烷转化率为50%,结合化学三行计算列式计算平衡状态物质的量,气体压强之比等于其物质的量之比,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,平衡常数K=$\frac{{p}^{2}({H}_{2}){p}^{2}(CO)}{p(C{H}_{4}){p}^{2}(C{O}_{2})}$;
(3)根据氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒计算c(NH4+),根据NH4++H2O?NH3•H2O+OH-结合K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$进行计算.
解答 解:(1)①2H2(g)+O2 (g)=2H2O (l)△H=-283.0kJ•mol-1 ①
2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-726.0kJ•mol-1 ②
依据盖斯定律①×3-②得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)△H=-123kJ•mol-1;
热化学方程式为:CO2 (g)+3H2 (g)=CH3OH(l)+H2O (l)△H=-61.5kJ•mol-1;
故答案为:CO2 (g)+3H2 (g)=CH3OH(l)+H2O (l)△H=-61.5kJ•mol-1;
②根据图2,甲槽为CO2得电子发生还原反应生成CH3OH,反应式为CO2+6e-+6H+═CH3OH+H2O,故答案为:CO2+6e-+6H+═CH3OH+H2O;
(2)对于CH4(g)+CO2(g)=2CO(g)+2H2(g),反应是气体体积增大的反应,
①a.平衡时反应混合物各组分的浓度不变,CO2的浓度不再发生变化,说明到达平衡,故a正确;
b.υ正(CH4)=2υ逆(CO),则υ正(CH4):υ逆(CO)=2:1,不等于化学计量数之比,未处于平衡状态,正反应速率大于逆反应速率,平衡向正反应进行,故b错误;
c.CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故c错误;
d.反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,故d正确;
故答案为:ad;
②由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故答案为:P4>P3>P2>P1;反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低;
③在恒容密闭容器中通入n mol CH4与,n mol CO2,反应在图象中X点的甲烷转化率为50%,
CH4(g)+CO2(g)?2CO+2H2(g),
起始量(mol) n n 0 0
变化量(mol) 0.5n 0.5n n n
平衡量(mol) 0.5n 0.5n n n
则P(CH4)=P(CO2)=$\frac{0.5n}{0.5n+0.5n+n+n}$×P4=$\frac{0.5}{3}$P4,P(CO)=P(H2)=$\frac{n}{3n}$P4=$\frac{1}{3}$P4
Kp=$\frac{{P}^{2}(CO){P}^{2}({H}_{2})}{P(C{H}_{4})P(C{O}_{2})}$=$\frac{(\frac{1}{3}{P}_{4})^{2}(\frac{1}{3}{P}_{4})^{2}}{\frac{0.5}{3}{P}_{4}×\frac{0.5}{3}{P}_{4}}$=$\frac{4}{9}$P42,
故答案为:$\frac{4}{9}$P42;
(3)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O?(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,
NH4++H2O?NH3•H2O+H+;
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{0.004×1{0}^{-7}}{0.1}$=4×10-9,
故答案为:0.1mol/L;4×10-9 ;
点评 本题考查热化学方程式书写、化学反应速率、化学平衡常数和平衡的移动原理、弱碱根离子在溶液中的水解平衡的计算应用等知识,综合性较大,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为Fe-3e-═Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2O2↑ | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 | B. | 氯化钾 | C. | 氯化铜 | D. | 氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 | B. | CH4 C3H4 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉、氯化钾、硫酸钡 | B. | 氯水、次氯酸钠、乙醇 | ||
| C. | 液氯、胆矾、干冰 | D. | 重水、烧碱、水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com