
【题目】化学是一门以实验为基础的学科
(1)从氯化钾溶液中得到氯化钾固体,常用的方法是______________。
(2)从碘水中分离出碘,实验方法的名称为____________,该方法主要实验仪器是____。
(3)现有A、B两种有机物的液态混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
①分离上述A、B的混合物,常用的方法是______;
②如图是某同学设计的分离A、B混合物的操作示意图,请在其冷凝管处标上进出水方向(用箭头↑表示)______;蒸馏烧瓶内碎瓷片的作用是______。
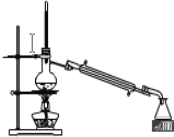
【答案】蒸发结晶 萃取分液 分液漏斗 蒸馏 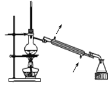 防止暴沸
防止暴沸
【解析】
从溶液中提取溶质,或分离混合物,常根据混合物的溶解性和沸点,确定采用何种物理方法。如固、固混合物,采用蒸发结晶或降温结晶法进行分离;从盐溶液中提取溶质,采用蒸发结晶法提取溶质;分离互溶的两种液体,采用蒸馏法分离。
(1)从氯化钾溶液中得到氯化钾固体,常用的方法是蒸发结晶;
答案为:蒸发结晶。
(2)从碘水中分离出碘,实验方法的名称为萃取分液,该方法主要实验仪器是分液漏斗;
答案为:萃取分液;分液漏斗。
(3)①因为二者的沸点相差大,所以分离上述A、B的混合物,常用的方法是蒸馏;
答案为:蒸馏;
②蒸馏时采用逆向通入冷却水,因此在其冷凝管处标上进出水方向为(用箭头↑表示) ;蒸馏烧瓶内碎瓷片的作用是防止暴沸;
;蒸馏烧瓶内碎瓷片的作用是防止暴沸;
答案为: ;防止暴沸。
;防止暴沸。


科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
4NO2(g)+ O2(g) △H >0 T1温度下的部分实验数据为:
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是
A. 500s内N2O5分解速率为2.96×10—3mol/(L· s)
B. T1温度下的平衡常数为K1=125(mol/L)3,1000s时转化率为50%
C. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1> K3
D. 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比) 后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是______(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度 C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器
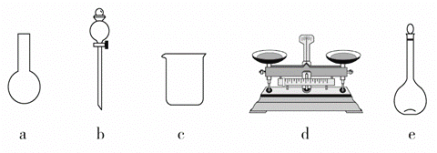
②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制230mL 2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列关于烷烃的表述正确的是
A. 乙烷的结构式为CH3CH3
B. C5H12分子的某种结构为![]()
C. ![]() 与
与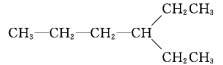 互为同分异构体
互为同分异构体
D. C4 H10的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,向20 mL 0.1 mol·L1ROH溶液中滴加0.1 mol·L1盐酸,混合溶液的pH与盐酸体积的关系如图所示。已知298 K时ROH的电离度为1.37%,lg 1.37≈0.1。下列说法正确的是
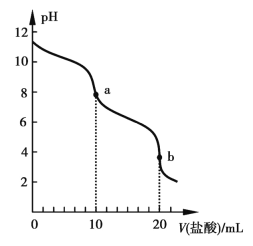
A. 水的电离程度:a>b
B. pH=7时,溶液中c(R+)=c(Cl)=c(H+)=c(OH)
C. b点溶液中存在c(C![]() )>c(R+)>c(OH)>c(H+)
)>c(R+)>c(OH)>c(H+)
D. 298 K时0.1 mol·L1ROH溶液的pH≈11.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:①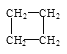 ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤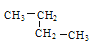 ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 _______种,其中________(结构简式)在苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
又知:![]()

![]() ,
,![]()

 ;
;
判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. HCl中H—Cl 键比H2O中H—O键稳定
D. 由题中所提供信息判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸钠粉末,pH增大,溶液漂白性减弱
D. 光照过程中,有气泡冒出,溶液的导电性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com