
(1)浓H2SO4的物质的量浓度。
(2)反应后剩余Zn粉的质量。
(1)16.0 mol·L-1 (2)
解析:因Zn粉过量,随反应进行,浓H2SO4变稀,故先产生SO2气体,后产生H2,设
则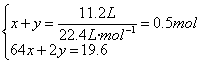
求得![]()
根据Zn + 2H2SO4![]() ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
1mol 2mol 1mol
0.3mol 0.6mol 0.3mol
Zn + H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
1mol 1mol 1mol
0.2mol 0.2mol 0.2mol
则参加反应的H2SO4的物质的量为:(0.6+0.2) mol=0.8 mol,
![]()
参加反应的Zn的物质的量为:n(Zn)=(0.3+0.2) mol=0.5 mol,
即


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:阅读理解
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1582 | 0.00 | 29.90 | 40.90 |
| 0.1582 | 0.00 | 30.10 | 41.10 |
| 0.1582 | 0.00 | 32.10 | 43.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水。
Ⅱ、 。
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42—)== ;
FeC2O4 的质量分数为 (精确到0.01%)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| …… | …… | …… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
查看答案和解析>>
科目:高中化学 来源:09-10年泰州中学高二下学期期末考试化学卷 题型:实验题
(12分)某草酸亚铁样品中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O。
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后(不含Fe3+),继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml。
③ 。
④数据处理。
请回答下列问题:
⑴上述实验方案中的步骤③是 ▲ 。
⑵洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、 ▲ ;
Ⅱ、用高锰酸钾标准溶液润洗滴定管;
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ、 ▲ 。
⑶步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 ▲ 溶液的试管中,如 ▲ ,则说明溶液合格。
⑷某实验探究小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1582 |
0.00 |
29.90 |
40.90 |
|
0.1582 |
0.00 |
30.10 |
41.10 |
|
0.1582 |
0.00 |
32.10 |
43.10 |
根据数据计算0.1582g 样品中:n(Fe2+)= ▲ ; n(C2O42—)= ▲ ;
FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为 ▲ 。(精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com