
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为 ( )。
A.3.2 g B.4.0 g
C.4.2 g D.4.6 g
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有________(填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有________。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精
d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为__________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有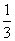 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“东方之冠”的主体结构是用国产Q460钢制成的。下列有关Q460钢的说法可能不正确的是 ( )。

A.硬度比纯铁大 B.性能优于普通钢
C.熔点比纯铁高 D.属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )。
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜(2014·全国新课标Ⅰ,8D)
②室温下,不能将浓硫酸盛放在铁桶中(2014·全国大纲,6B)
③K+、Fe3+、NO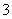 、SCN-在水溶液中能大量共存(2014·广东理综,8D)
、SCN-在水溶液中能大量共存(2014·广东理综,8D)
④因氧化铁能与酸反应,可用于制作红色涂料(2014·江苏化学,4D)
⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质(2014·四川理综,4B)
A.仅①②③ B.仅①③④
C.仅②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1 FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:___________________________。
②乙同学认为可能是发生了氧化还原反应,其中Fe3+→Fe2+;请写出Fe3+跟SO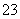 反应的离子方程式_____________________________________________
反应的离子方程式_____________________________________________
________________________________________________________。
乙同学查阅资料得知:
| 1.Fe2+与SO 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因____________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是 ( )。

A.图中C点铝元素存在形式是AlO
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合溶液中c[Al2(SO4)3]∶c(AlCl3)=1∶2
D.OA段反应的离子方程式为2Al3++3SO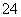 +3Ba2++8OH-===2AlO
+3Ba2++8OH-===2AlO +3BaSO4↓+4H2O
+3BaSO4↓+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的Na2O2与CO2反应后的固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应,下列说法正确的是 ( )。
A.41.8 g固体物质为Na2CO3
B.41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物
C.41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物
D.一定量的Na2O2为78 g
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是 ( )。
 +
+ +
+ ―→
―→ +
+ +
+
A.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
把一块镁铝合金投入到1 mol/L HC1溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积
变化的关系如下图所示。下列说法中错误的是
A.HCl溶液的体积为80 mL
B.a的取值范围为0≤a<50
C.当a值为30时,b值为0.01
D.当a值为10时,b值为0.03
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com