
【题目】实验室有质量分数为98%的浓硫酸,密度为1.84 g·cm-3。现要配制0.5mol/L的稀硫酸450 mL,试回答下列问题:
(1)该浓硫酸的物质的量浓度为_________。配制稀硫酸时,应选用规格为______mL的容量瓶,经计算需要__________mL浓硫酸。
(2)在量取浓硫酸后,进行了下列操作,其正确顺序是________________(填序号)。
a. 待稀释硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. 往容量瓶中小心加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与刻度标线相切。
c. 用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
d. 将浓硫酸慢慢注入盛蒸馏水的烧杯中,边倒边用玻璃棒搅动,使其混合均匀。
e. 将容量瓶盖紧,反复上下颠倒,摇匀。
(3)下列操作会导致所配硫酸浓度偏低的是______。
A.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
B.用量筒量取浓硫酸时,俯视读数
C.定容时仰视容量瓶刻度线
D.定容摇匀后有少量溶液外流
E. 定容摇匀后,发现液面下降,继续加水至刻度线
【答案】 18.4mol·L-1 500 13.6 d a c b e BCE
【解析】(1).浓硫酸的密度为1.84 g·cm-3=1840 g·L-1,则c(浓硫酸)=![]() ;离450 mL体积最接近的为500 mL容量瓶;0.5mol/L的稀硫酸500mL需要硫酸的物质的量为0.25mol,则需要浓硫酸的物质的量为
;离450 mL体积最接近的为500 mL容量瓶;0.5mol/L的稀硫酸500mL需要硫酸的物质的量为0.25mol,则需要浓硫酸的物质的量为![]() 13.6mL;
13.6mL;
(2).首先配制溶液→冷却至室温后倒入容量瓶→洗涤配制使用器具,将洗涤水倒入容量瓶→→定容→震荡摇匀。故答案为:d a c b e;
(3). A.不影响,B.俯视读数,读取的数值比实际大,会使取得的硫酸量减少,使浓度偏低;
C.定容仰视,使得加入的水量增加使浓度偏低; D.定容摇匀洒出的溶液与剩余的溶液中硫酸的物质的量的浓度相等,洒出对溶液浓度不影响;E. 定容摇匀后,液面下降对溶液物质的量浓度不影响,加入水后会使硫酸浓度偏低。故选择BCE。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I->Fe2+>H2O2。据此判断下列反应不能发生的是
A. 2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+
+4H+
B. H2O2+H2SO4=SO2↑+O2↑+2H2O
C. SO2+I2+2H2O=H2SO4+2HI
D. 2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们分别位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是( )
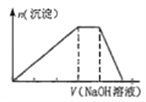
A. 简单氢化物的沸点:Y>X
B. 简单离子的半径:M>Y>Z
C. R与除Z以外的其他3种元素均能形成共价化合物
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃与人们的生产生活密切相关,玻璃制品随处可见。
(1)一般住宅的玻璃窗是普通玻璃,制造普通玻璃的主要原料是________、________、________,将原料粉碎后放入玻璃窑中在高温条件下发生反应即可制得玻璃,则普通玻璃的主要成分是________、________、________。
(2)某玻璃用三种氧化物的组合形式表示组成时,其中Na2O、CaO、SiO2的质量之比为31∶28∶180,则此玻璃的组成为________(填序号)。
A.Na2O·CaO·6H2SiO3
B.Na2O·CaO·6SiO2
C.2Na2O·2CaO·9SiO2
D.6Na2O·6CaO·SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述错误的是
A. 将6.2 g氧化钠溶于水配成1L溶液,其中溶质的物质的量浓度为0.2mol·L-1
B. 将1 L0.2 mol·L-1 Ca(NO3)2溶液稀释到10 L时,NO![]() 的浓度为0.04 mol·L-1
的浓度为0.04 mol·L-1
C. 用1L水吸收标准状况下的22.4L氨气所得氨水中,c(NH3·H2O)=1mol·L-1
D. 5 mL2 mol·L-1 NaCl溶液和10 mL 0.5 mol·L-1 MgCl2溶液中,n(Cl-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
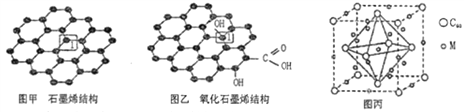
(1)图甲中,1号C与相邻C形成σ键的个数为__________。
(2)图乙中,1号C的杂化方式是__________,该C与相邻C形成的键角__________(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为____________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
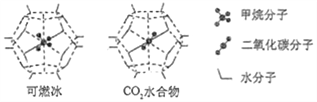
①“可燃冰”中分子间存在的2种作用力是___________________________;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想的依据是:___________________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是
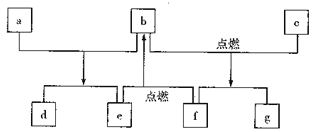
A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 铁跟稀硫酸反应:2Fe + 6H+ ===2Fe3+ + 3H2 ↑
B. 盐酸与澄清石灰水反应:H+ + OH===H2O
C. 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓
D. 二氧化碳通入足量的氢氧化钠溶液:CO2 + OH===![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙可以作为生氢剂(其中CaH2中氢元素为﹣1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( )
A.既不是氧化剂也不是还原剂
B.是氧化剂
C.是还原剂
D.既是氧化剂又是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com