
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,该化合物为水,则A为H元素、C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为:6-1=5,B的原子序数小于O,则B为N元素;
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素,以此解答该题.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,该化合物为水,则A为H元素、C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为:6-1=5,B的原子序数小于O,则B为N元素;
A、D同主族,D的原子序数大于O,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数为18的气体分子,则F为Cl元素,
根据以上分析可知:A为H元素、B为N元素、C为O元素、D为Na元素、E为S元素、F为Cl元素.
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大;
E为6元素,其原子序数为16,最外层为6个分子,含有3个电子层,位于周期表中第三周期ⅥA族,
故答案为:Na;第三周期ⅥA族;
(2)Na与H可形成化合物NaH,该化合物的电子式为Na+[:H]-,故答案为:Na+[:H]-;
(3)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该化合物为H2SO4,该反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)E为S元素、F为Cl元素,非金属性越强,其氢化物越稳定,则二者氢化物稳定性大小为:HCl>H2S,故答案为:HCl;H2S;
(5)元素C、D可形成的原子个数比为1:1的化合物为Na2O2,与水反应的方程式为2Na2O2+2H2O═4NaOH+O2↑,与二氧化碳反应的方程式为2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2↑;
(6)实验室用二氧化锰和浓盐酸在加热条件下制备氯气,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
点评 本题考查位置、结构、性质的关系及应用,综合性较强,考查知识点较多,元素的推断是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口.并熟悉元素化合物的性质来解答,难度较大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=v(NH3) | C. | 2v(N2)=v(NH3) | D. | v(N2)=3v(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金粉和铁粉混合 | B. | 将牛奶加入水中混合 | ||
| C. | 蒸发食盐水制取食盐晶体 | D. | 用漏斗、滤纸过滤除去水中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )| A. | 做该实验时环境温度可能为20℃ | B. | 该实验表明化学能可以转化为热能 | ||
| C. | NaOH溶液的浓度约是1.5mol•L-1 | D. | 该实验表明中和反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HO3(浓)=3Cu(NO3)2+2NO↑+4H2O | ||
| C. |  | D. | 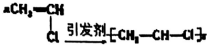 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com