
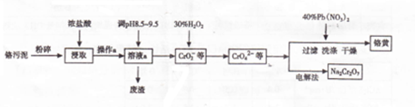
分析 流程分析可知,铬污泥(主要成分为Cr2O3,杂质为Fe2O3、Al2O3、SiO2)为原料粉碎后在反应器中加入浓盐酸浸取,因二氧化硅不反应,经过滤可得到废渣为二氧化硅,溶液a中含有Fe3+、Al3+、Cr3+等,加入碳酸钠溶液调节pH8.5~9.5,可除去Fe3+、Al3+,得到的废渣为Al(OH)3和Fe(OH)3,在CrO22-溶液中加入过氧化氢,经氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;由流程图可知,操作a是把溶液与不溶物分离,应是过滤;
(2)制备铬黄和Na2Cr2O2,除去杂质离子且加入试剂调节溶液PH不能引入新的杂质;
(3)该温度下反应Al3++3H2O?Al(OH)3+3H+的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(A{l}^{3+})}$=$\frac{{c}^{3}({H}^{+})×{c}^{3}(O{H}^{-})}{c(A{l}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$;
(4)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水;
(5)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(6)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解电解消耗OH-提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O.
解答 解:(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
由流程图可知,操作a是把溶液与不溶物分离,应是过滤;
故答案为:增大接触面积,提高浸取率;过滤;
(2)制备铬黄和Na2Cr2O2,除去杂质离子且加入试剂调节溶液PH不能引入新的杂质,调整溶于a的pH为8.5-9.5的目的是除去Fe3+、Al3+,调节溶液PH的试剂为,
A.Cu(OH)2 和酸反应后引入铜离子,故A错误;
B.NaOHi调节溶液PH且不引入新的杂质,故B正确;
C.Na2CO3 碱性较强可以调节溶液PH,故C正确;
D.NaHCO3 溶液碱性较弱,不能调节溶液PH到8.5-9.5,故D错误;
故答案为:B
(3)该温度下反应Al3++3H2O?Al(OH)3+3H+的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(A{l}^{3+})}$=$\frac{{c}^{3}({H}^{+})×{c}^{3}(O{H}^{-})}{c(A{l}^{3+}){c}^{3}(O{H}^{-})}$=$\frac{K{w}^{3}}{Ksp}$=$\frac{(1×1{0}^{-14})^{3}}{1×1{0}^{-33}}$=1.0×10-9,
故答案为:1.0×10-9;
(4)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(5)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(6)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解消耗OH-,提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-═O2↑+2H2O,故答案为:正;4OH--4e-═O2↑+2H2O.
点评 本题考查了物质分离提纯的流程分析判断,主要是实验基本操作、除杂试剂选择、溶度积常数计算、原电池原理和电极反应书写等知识,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
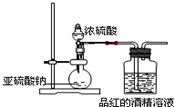 为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =8.4 | B. | >8.4 | C. | <8.4 | D. | ≤8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式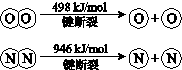
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.7% | B. | 8.7% | C. | 9% | D. | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
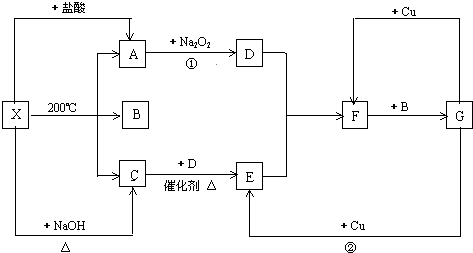
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
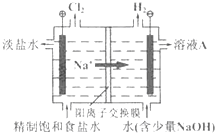 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com