
| A. | 碘的升华 | B. | 硅的熔化 | C. | 食盐电离 | D. | 氯化氢溶于水 |
科目:高中化学 来源: 题型:选择题
 常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )
常温下,实验测得1.0mol/L NH4HCO3溶液pH=8.0.平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )| A. | 常温下ka(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) | |
| B. | pH=13时,溶液中不存在HC03-的水解平衡 | |
| C. | pH由8~11时,$\frac{(C{O}_{3}^{2-})•c({H}^{+})}{c(HC{O}_{3}^{-})}$不变 | |
| D. | pH=3时,有c(NH4+)+c(NH3•H2O)═c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应:Na+2H2O→Na++2OH-+H2↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管、容量瓶和分液漏斗使用前都要检漏、干燥 | |
| B. | 滴定管没有用标准液润洗,会导致测定结果偏高 | |
| C. | 滴定管中加标准液后,要调节液面位置在零刻度或以下 | |
| D. | 胆矾结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
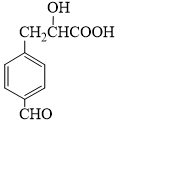
| A. | 能发生缩聚反应 | B. | 能发生消去反应 | ||
| C. | 1mol X最多消耗5 mol H2 | D. | 1mol X最多消耗2 mol Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的浓度大于盐酸溶液的浓度 | |
| B. | 相同体积的两溶液能中和等物质的量的氢氧化钠 | |
| C. | 两溶液稀释100倍,pH都为5 | |
| D. | 两溶液中分别加入少量对应的钠盐,c(H+) 均明显增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com