
(07年重庆卷)用食用白醋(醋酸浓度约1 mol?L-1)进行下列实验,能证明醋酸为弱电解质的是()
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
答案:D
解析:A选项白醋中滴入石蕊试液呈红色,只能说明醋酸显酸性,能发生电离是一种电解质,但不能说明强弱;B选项白醋加入豆浆中有沉淀产生,因豆浆是胶体,根据胶体的性质――聚沉,也只能说明醋酸是一种电解质;C选项蛋壳浸泡在白醋中有气体放出,只能说明醋酸是一种酸且酸性比碳酸强;而D选项pH试纸显示白醋的pH为2~3,即溶液中c(H+)=10-2~10-3mol?L-1,因食用白醋中醋酸浓度约1 mol?L-1,这说明醋酸没有完全电离,即存在电离平衡。所以只有D选项能说明醋酸为弱电解质。
高考考点:弱电解质的电离、弱电解质的证明。
易错提醒:本题比较简单容易理解,只是个别学生对C选项理解错误而可能错选。
备考提示:弱电解质在水溶液中不能完全电离,存在电离平衡。证明一种电解质是一种弱电解质就应从这方面出发,判断电解质强弱的方法有很多:(1)在相同浓度、相同温度下,可与强电解质做导电性对比实验;(2)在相同浓度、相同温度下,比较反应速率的快慢,如将相同的锌粒投入到等浓度的盐酸和醋酸中,结构前者比后者反应快;(3)浓度与pH的关系,如0.1mol?L-1 CH3COOH,若其pH>1。则可以说明醋酸是弱电解质;(4)测定对应盐的酸碱性。如CH3COONa溶液成碱性,则说明醋酸是弱酸;(5)稀释前后的pH与稀释倍数的变化关系,例如将pH=2的酸溶液稀释1000倍,若pH小于5,则证明酸为弱酸,若pH=5,则说明酸为强酸;(6)采用实验证明存在电离平衡,例如醋酸溶液中滴入石蕊试液变红,再加入醋酸铵固体,溶液颜色变浅。总之证明的方法有很多。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
(07年重庆卷)用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按题12图所示步骤分开五种离子。则溶液①、②、③、④是( )

A.①NaCl ②NaOH ③NH3?H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3?H2O ④NaCl
C.①H2SO4 ②NH3?H2O ③NaOH ④NaCl
D.①NaCl ②NH3?H2O ③NaOH ④H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 ________ 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 _____ ;该方法的优点是_________ 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=a(Pa2),则容器中的总压为 _____ Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
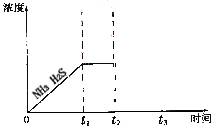
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年重庆卷)(16分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
 (1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是_____ 。再由a向c中加2 mL蒸馏水,c中的实验现象是__________ 。
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________ 。理由是_____________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(07年重庆卷)用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按题12图所示步骤分开五种离子。则溶液①、②、③、④是()
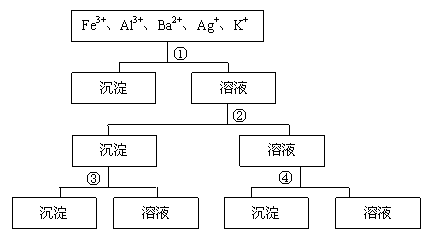
A. ①NaCl ②NaOH ③NH2?H2O ④H2SO4
B. ①H2SO4 ②NaOH ③NH3?H2O ④NaCl
C. ①H2SO4 ②NH3?H2O ③NaOH ④NaCl
D. ①NaCl ②NH3?H2O ③NaOH ④H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com