
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 元素③与⑧的金属性相比:前者强于后者 | |
| B. | 上述8种元素中,元素⑤的最高价氧化物对应的水化物酸性最强 | |
| C. | 元素⑦的气态氢化物与元素④的气态氢化物相比较:前者稳定性强,后者沸点高 | |
| D. | 元素①分别与元素②和⑥形成的化合物所含化学键类型不一定完全相同 |
分析 短周期元素中,①只有最低价-2,处于ⅥA族,则①为O;③⑥都最高正价+1,处于ⅠA,⑥的原子半径较大,③原子半径不是所以元素中最小,故③为Li、⑥为Na;⑤有+7、-1价,则⑤为Cl;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;②有最高价+2,处于ⅡA族,原子半径大于Li,则②为Mg;⑧有最高价+3,处于ⅢA族,原子半径小于Cl,则⑧为B,据此解答.
解答 解:短周期元素中,①只有最低价-2,处于ⅥA族,则①为O;③⑥都最高正价+1,处于ⅠA,⑥的原子半径较大,③原子半径不是所以元素中最小,故③为Li、⑥为Na;⑤有+7、-1价,则⑤为Cl;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;②有最高价+2,处于ⅡA族,原子半径大于Li,则②为Mg;⑧有最高价+3,处于ⅢA族,原子半径小于Cl,则⑧为B.
A.③为Li、⑧为B,同周期元素从左向右,金属性逐渐减弱,故Li的金属性强于B,故A正确;
B.⑤为Cl,上述8种元素中,氯元素最高价氧化物对应的水化物酸性最强,故B正确;
C.④为P、⑦为N,同主族元素从上向下,氢化物的稳定性逐渐减弱,所以磷化氢的稳定性弱于氨气,氨分子之间有氢键,所以氨气的沸点高于磷化氢,故C错误;
D.元素①分别与元素②形成的化合物为MgO,含有离子键,元素①和⑥形成的化合物为Na2O2,含有离子键和共价键,所以它们所含化学键类型不一定完全相,故D正确,
故选:C.
点评 本题考查元素周期表与元素周期律的综合应用,根据化合价与原子半径推断元素是解答的关键,注意对元素周期律的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
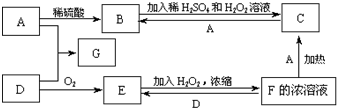 中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入硝酸银,产生白色沉淀,再加稀硝酸,沉淀不溶解,则溶液中一定有Cl- | |
| D. | 加入KSCN,溶液变血红色,则溶液中一定有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
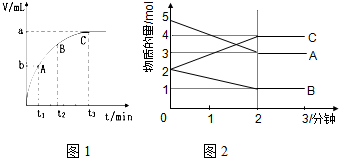
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法,不正确的是( )
的说法,不正确的是( )| A. | 既可催化加氢,又能使酸性KMnO4溶液褪色 | |
| B. | 可与浓溴水发取代生反应,但不能发生消去反应 | |
| C. | 1mol该化合物最多可与10molNaOH反应 | |
| D. | 可与FeCl3溶液发生显色反应,不与NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com