
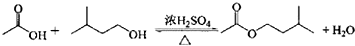
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
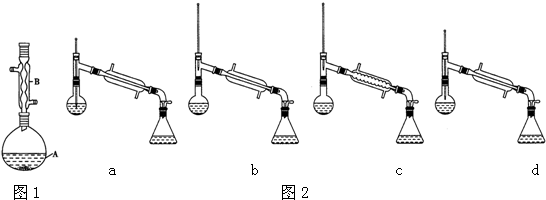
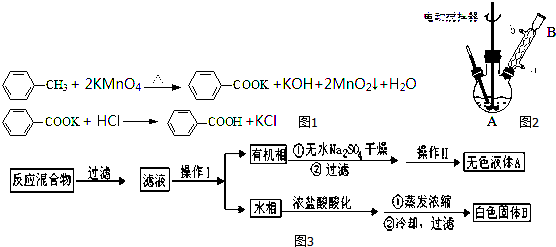
分析 在装置A中加入反应混合物和2~3片碎瓷片,开始缓慢加热A,利用冷凝管冷凝回流50分钟,反应液冷至室温后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用水洗涤碳酸氢钠溶液,分出的产物加入少量无水硫酸镁固体作干燥剂,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯,还考查了反应物转化率的提高方法,同时进行产率的计算有误差分析;
(1)根据题中仪器B的构造判断该仪器的名称;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(4)根据反应物对增加一种反应物的浓度,可以使另一种反应物的转化率提高进行判断加入过量乙酸的目的;
(5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(6)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率.
解答 解:(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管,故答案为:球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,
故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故答案为:d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率,
故答案为:提高醇的转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥,
故答案为:干燥乙酸异戊酯;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b,
故答案为:b;
(7)乙酸的物质的量为:n=$\frac{6.0g}{60g/mol}$=0.1mol,异戊醇的物质的量为:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为=$\frac{3.9g}{130g/mol}$=0.03mol,所以实验中乙酸异戊酯的产率为:$\frac{0.03mol}{0.05mol}$×100%=60%,
故答案为:c.
点评 本题考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
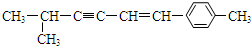 ,下列说法中正确的是( )
,下列说法中正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能共面的碳原子数最多为13个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
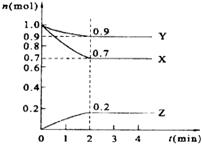 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com