
| A. | 硅可用作制造变压器的铁芯材料 | |
| B. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| C. | 二氧化硅可用于制造光导纤维 | |
| D. | 石英玻璃可用于制造光学仪器 |
分析 A.硅钢本身是一种导磁能力很强的磁性物质;
B.水晶的主要成分是二氧化硅;
C.光导纤维的主要成分是二氧化硅;
D.石英主要成分为二氧化硅,二氧化硅具有良好的光学特性.
解答 解:A.硅钢本身是一种导磁能力很强的磁性物质,可以用做制造变压器铁芯的材料,故A正确;
B.水泥、玻璃是硅酸盐产品,水晶的主要成分是二氧化硅,故B错误;
C.光导纤维的主要成分是二氧化硅,故C正确;
D.石英主要成分为二氧化硅,二氧化硅具有良好的光学特性,所以石英玻璃可用于制造光学仪器,故D正确;
故选B.
点评 本题考查了硅及其化合物的性质和用途,明确二氧化硅、硅及硅酸盐的性质是解题关键,掌握基础是解题关键,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 在通常情况下其单质均为气体 | B. | 其单质均由双原子分子组成 | ||
| C. | 都属于非金属元素 | D. | 每种元素都只有一种氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| B. | 次氯酸分子的电子式: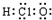 | |
| C. | 乙酸乙酯的结构简式: | |
| D. | Al(OH)3的电离:H++AlO2-+H2O?Al(OH)2?Al3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,请回答以下问题:
,请回答以下问题: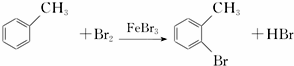 .
.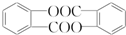 .
.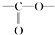 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闪电时,氮气与氧气反应 | B. | 合成氨反应 | ||
| C. | 用氨气合成尿素 | D. | 金属镁在氮气中燃烧生成Mg3N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.
,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
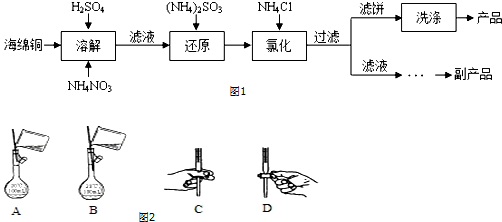
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定都是氧化还原反应 | |
| B. | 化合反应不一定都是氧化还原反应 | |
| C. | 复分解反应一定都不是氧化还原反应 | |
| D. | 氧化还原反应都是置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com